Données techniques
| Formule | C12H14N4O3.HCl |
|||
| Poids moléculaire | 298.73 | Numéro CAS | 120964-45-6 | |
| Solubilité (25°C)* | In vitro | DMSO | 60 mg/mL (200.85 mM) | |
| Water | 60 mg/mL (200.85 mM) | |||
| Ethanol | Insoluble | |||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
||||
Préparation des solutions mères
Activité biologique
| Description | Le chlorhydrate de DZNep (3-déazaneplanocin A), un analogue de l'adénosine, est un inhibiteur compétitif de la S-adénosylhomocystéine hydrolase avec un Ki de 50 pM dans un essai acellulaire. | ||
|---|---|---|---|
| Cibles |
|
||
| In vitro | 3-Deazaneplanocin A (1,0 μM) entraîne une augmentation significative de l'accumulation de cellules en phase G0/G1 (58,5 %) avec une diminution concomitante du nombre de cellules en phase S (35,2 %) et en phases G2/M (6,3 %) du cycle cellulaire des cellules de leucémie myéloïde aiguë humaine OCI-AML3. 3-Deazaneplanocin A (1,0 μM) induit l'apoptose dans les cellules OCI-AML3 (~50 %) et HL-60 (~50 %), et une réduction de plus de 90 % de la croissance des colonies à 48 h. 3-Deazaneplanocin A réduit les niveaux de EZH2 et inhibe la triméthylation de la lysine 27 sur l'histone H3 dans les cellules HL-60 et OCI-AML3 et dans les cellules primaires de LAM. Le traitement par 3-Deazaneplanocin A induit p16, p21, p27 et FBXO32 tout en réduisant les niveaux de cycline E et de HOXA9. 500 nM de 3-Deazaneplanocin A induit la différenciation des cellules HL-60 en cellules CD11b+ par près de 3 fois à 48 h. 3-Deazaneplanocin A a une excellente activité contre plusieurs types viraux. 3-Deazaneplanocin A est actif contre la stomatite vésiculaire dans les cellules L929, la parainfluenza 3 dans H.Ep-2, les virus de la vaccine et de la fièvre jaune dans les cellules vero avec des IC50 de 0,2, 3,6, 2,1 et 2,9 μg/mL, respectivement. 3-Deazaneplanocin A présente un effet fortement et uniformément leishmanistatique sur les souches américaines de Leishmania (L mexicana et L brasiliensis) dans l'étude avec une ID50 moyenne de 96 ng/mL, mais ne montre aucune inhibition contre les plusieurs souches de T. cruzi et T. rangeli testées avec des concentrations allant jusqu'à 10 μg/mL. À une dose de 200 ng/mL, 3-Deazaneplanocin A inhibe l'incorporation de S-adénosyl-L-3H-méthylméthionine et de 3-thymidine par les promastigotes après quatre jours. À une dose de 100 ng/mL, 3-Deazaneplanocin A élimine environ 56 % de L mexicana et L brasiliensis des macrophages humains infectés. |
||
| In vivo | 3-Deazaneplanocin A montre une activité antileucémique in vivo. La 3-Deazaneplanocin A à des doses de 8 mg/kg montre une activité antivirale in vivo contre le virus de la vaccine dans un test de variole de la queue de souris avec une médiane de 0,0 poxftail (84 % de protection). La 3-Deazaneplanocin A à des doses allant de 0,5 à 1,5 mg/kg/jour, a significativement réduit le développement de l'infection cutanée leishmanienne produite chez des souris BALB/c consanguines par inoculation de L. b. guyanensis. La 3-Deazaneplanocin A induit une production massivement accrue d'interféron-α chez les souris infectées par le virus Ebola. La 3-Deazaneplanocin A (injection s.c. de 2 mg/kg post-infection) prévient la mort chez les souris infectées par 1000 pfu (30 000 LD50) d'EBO-Z adapté à la souris. Le traitement avec la 3-Deazaneplanocin A au jour 1 réduit les titres viraux sériques moyens au jour 2 par un facteur de 100 et au jour 3 par un facteur de 100 000, par rapport aux contrôles sous placebo, et entraîne un niveau sérique moyen d'IFN-α de 1420 pg/mL au jour 2 et de 1830 pg/mL au jour 3. |
||
| Caractéristiques | Analogue carbocyclique de l'adénosine, et agit comme inhibiteur anti-tumoral et anti-viral de EZH2. |
Protocole (de référence)
| Test kinase : |
|
|---|---|
| Test cellulaire : |
|
| Étude animale : |
|
Références
|
Validation du produit par le client
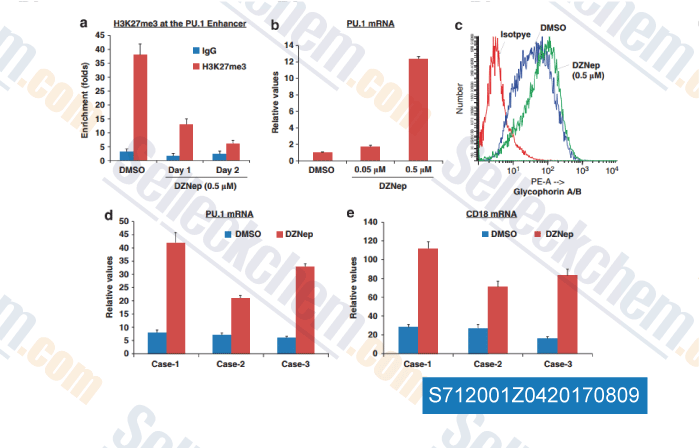
-
Données de [ , , Leukemia, 2013, 1291-1300 ]
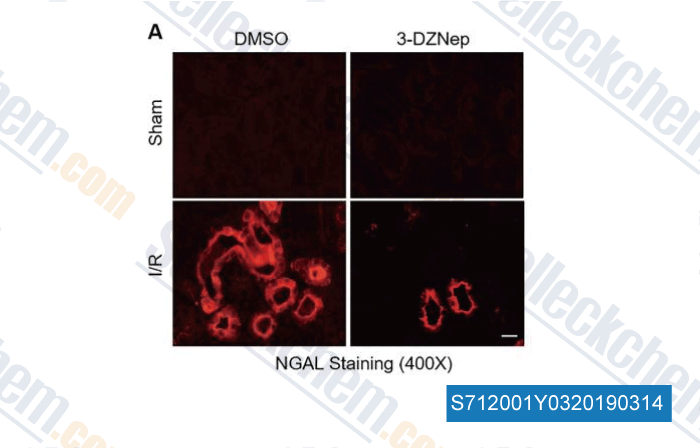
-
Données de [ , , Cell Death Dis, 2018, 9(11):1067 ]
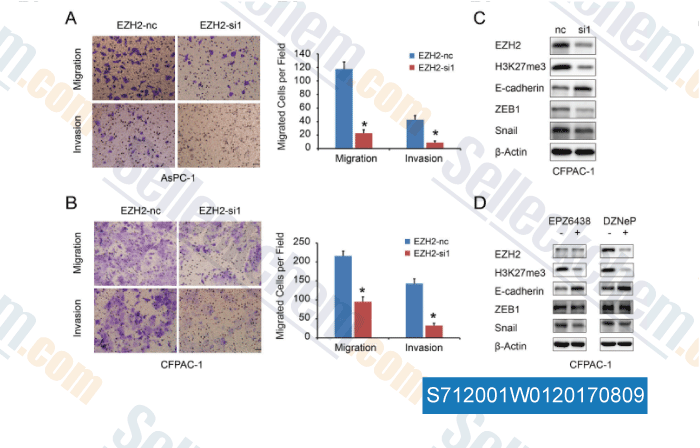
-
Données de [ , , Oncotarget, 2016, 7(10):11194-207 ]
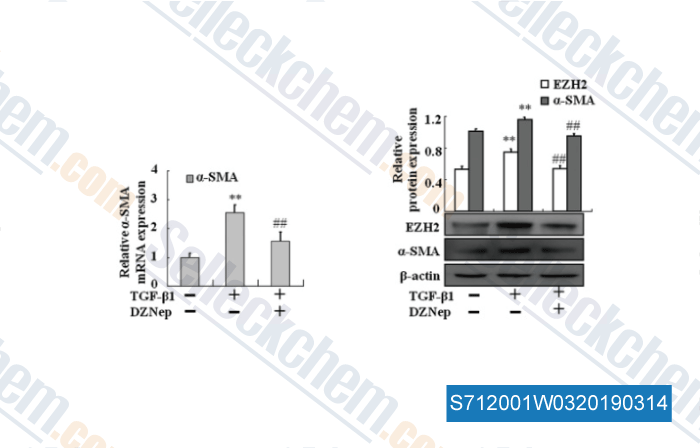
-
Données de [ , , J Cell Mol Med, 2017, 21(10):2317-2328 ]
Sellecks 3-Deazaneplanocin A (DZNep) Hydrochloride A été cité par 97 Publications
| Atlas of amnion development during the first trimester of human pregnancy [ Nat Cell Biol, 2025, 27(7):1175-1185] | PubMed: 40659869 |
| LINE1 elements at distal junctions of rDNA repeats regulate nucleolar organization in human embryonic stem cells [ Genes Dev, 2025, 39(3-4):280-298] | PubMed: 39797762 |
| Breaking the link between morphology and potency for mESCs [ Cell Biosci, 2025, 15(1):146] | PubMed: 41131638 |
| [C6TSEDRVAJZ, a combination of small-molecule compounds, induces differentiation of human placental fibroblasts into epithelioid cells in vitro] [ Nan Fang Yi Ke Da Xue Xue Bao, 2025, 45(2):322-330] | PubMed: 40031976 |
| Epigenetic modifiers to treat retinal degenerative diseases [ bioRxiv, 2025, 2025.05.22.655558] | PubMed: 40501782 |
| Key epigenetic and signaling factors in the formation and maintenance of the blood-brain barrier [ Elife, 2024, 12RP86978] | PubMed: 39670988 |
| Transposable element activity captures human pluripotent cell states [ EMBO Rep, 2024, 10.1038/s44319-024-00343-y] | PubMed: 39668246 |
| Enhancer of Zeste Homolog 2 Inhibition Induces HLA Class I Re-Expression in Merkel Cell Carcinoma [ J Invest Dermatol, 2024, 144(6):1398-1401.e1.] | PubMed: 38052265 |
| Perinuclear assembly of vimentin intermediate filaments induces cancer cell nuclear dysmorphia [ J Biol Chem, 2024, 300(12):107981] | PubMed: 39542246 |
| Activation of the CCL22/CCR4 causing EMT process remodeling under EZH2-mediated epigenetic regulation in cervical carcinoma [ J Cancer, 2024, 15(19):6299-6314] | PubMed: 39513112 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
