Données techniques
| Formule | C21H21FN6O |
||||||
| Poids moléculaire | 392.43 | Numéro CAS | 405169-16-6 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 40 mg/mL (101.92 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | Dovitinib (TKI-258, CHIR258) est un inhibiteur de RTK multi-cibles, ciblant principalement les RTKs de classe III (FLT3/c-Kit) avec des valeurs d'IC50 de 1 nM/2 nM. Il est également puissant contre les RTKs de classe IV (FGFR1/3) et de classe V (VEGFR1-4), présentant des valeurs d'IC50 de 8 à 13 nM, tout en montrant une puissance plus faible envers InsR, EGFR, c-Met, EphA2, Tie2, IGF-1R et HER2 dans des essais sans cellules. Phase 4. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cibles |
|
|||||||||||
| In vitro | Dovitinib (TKI-258) inhibe puissamment la croissance stimulée par le FGF des cellules B9 exprimant WT et F384L-FGFR3 avec une IC50 de 25 nM. De plus, il inhibe la prolifération des cellules B9 exprimant chacune des diverses mutations activées de FGFR3. Fait intéressant, des différences minimales sont observées dans la sensibilité des différentes mutations de FGFR3 à ce composé, avec une IC50 allant de 70 à 90 nM pour chacune des diverses mutations. Les cellules B9 dépendantes de l'IL-6 contenant uniquement le vecteur (cellules B9-MINV) sont résistantes à son activité inhibitrice à des concentrations allant jusqu'à 1 µM. Il inhibe la prolifération cellulaire des cellules KMS11 (FGFR3-Y373C), OPM2 (FGFR3-K650E) et KMS18 (FGFR3-G384D) avec une IC50 de 90 nM (KMS11 et OPM2) et 550 nM, respectivement. Le composé inhibe la phosphorylation d'ERK1/2 médiée par le FGF et induit une cytotoxicité dans les cellules MM primaires exprimant FGFR3. Les BMSC confèrent un degré modeste de résistance avec une inhibition de croissance de 44,6 % pour les cellules traitées avec 500 nM de Dovitinib et cultivées sur stroma, comparativement à une inhibition de croissance de 71,6 % pour les cellules cultivées sans BMSC. Il inhibe la prolifération de M-NFS-60, une lignée cellulaire myéloblastique de souris dont la croissance est stimulée par le M-CSF, avec une concentration efficace médiane (EC50) de 220 nM. Le traitement des cellules SK-HEP1 avec ce composé entraîne une réduction dose-dépendante du nombre de cellules et un arrêt en phase G2/M avec une réduction des phases G0/G1 et S, une inhibition de la croissance indépendante de l'ancrage et un blocage de la motilité cellulaire induite par le bFGF. L'IC50 pour ce composé dans les cellules SK-HEP1 est d'environ 1,7 µM. Il réduit également significativement les niveaux de phosphorylation basaux de FGFR-1, du substrat 2α de FGFR (FRS2-α) et d'ERK1/2, mais pas d'Akt, dans les cellules SK-HEP1 et 21-0208. Dans les cellules HCC 21-0208, il inhibe significativement la phosphorylation de FGFR-1, FRS2-α, ERK1/2 induite par le bFGF, mais pas d'Akt. |
|||||||||||
| In vivo | Dovitinib (TKI-258) induit des réponses à la fois cytostatiques et cytotoxiques in vivo, entraînant la régression des tumeurs exprimant FGFR3. Il montre une inhibition dose-dépendante et exposition-dépendante des récepteurs tyrosine kinases (RTK) cibles exprimés dans les xénogreffes tumorales. Ce composé inhibe puissamment la croissance tumorale de six lignées de CHC. L'inhibition de l'Angiogenesis est corrélée à l'inactivation des voies de signalisation FGFR/PDGFRβ/VEGFR2. Dans un modèle orthotopique, il inhibe puissamment la croissance tumorale primaire et les métastases pulmonaires et prolonge significativement la survie des souris. L'administration de Dovitinib entraîne une inhibition significative de la croissance tumorale et des régressions tumorales, y compris des tumeurs grandes et établies (500-1 000 mm3). |
Protocole (de référence)
| Test kinase : |
|
|---|---|
| Test cellulaire : |
|
| Étude animale : |
|
Références
|
Validation du produit par le client
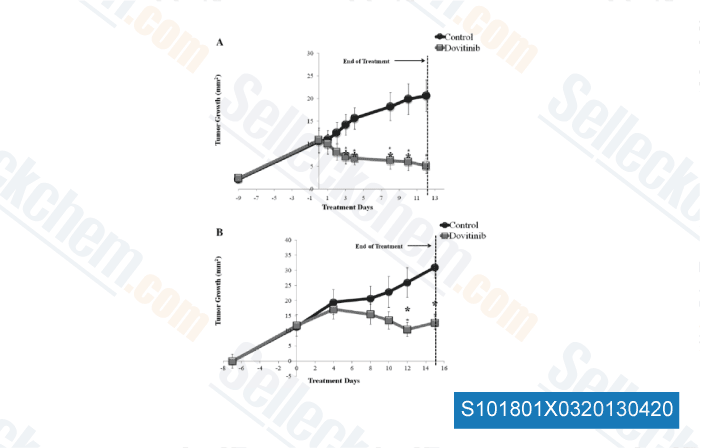
-
Données de [ Oral Oncol , 2012 , 48, 1242-9 ]
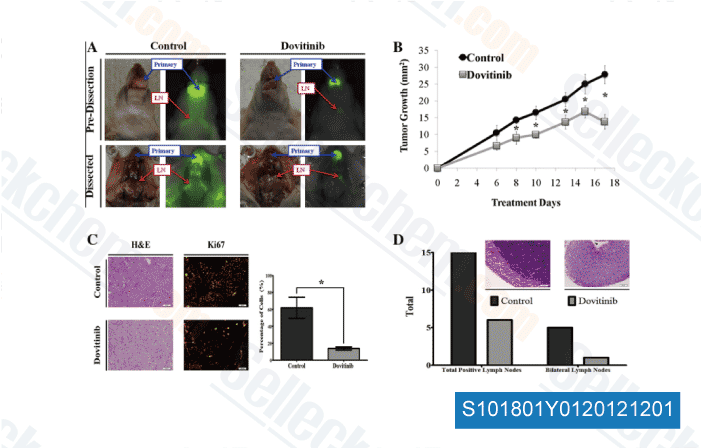
-
Données de [ Oral Oncol , 2012 , 48, 1242-9 ]
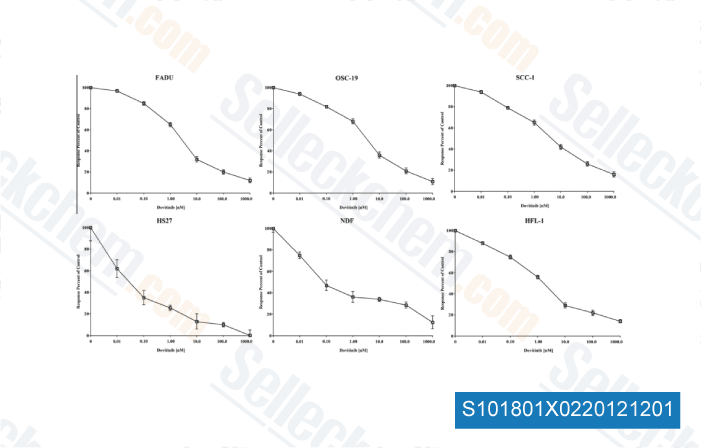
-
Données de [ Oral Oncol , 2012 , 48, 1242-9 ]
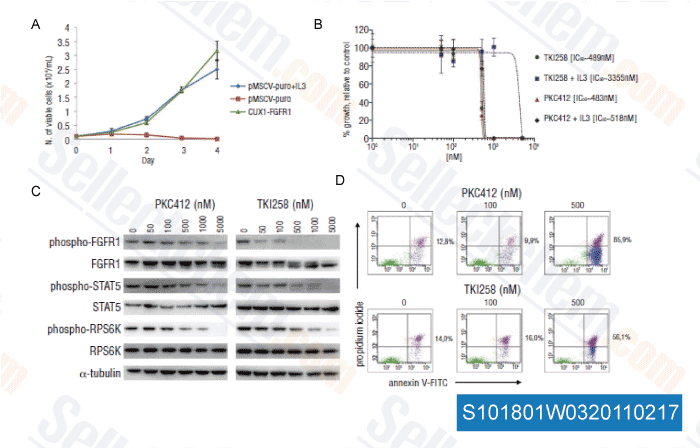
-
Données de [ Haematologica , 2011 , 96, 922-926 ]
Sellecks Dovitinib (TKI-258) A été cité par 54 Publications
| Characterization of dovitinib-human serum albumin association potential through optical spectroscopic and in silico approaches [ Spectrochim Acta A Mol Biomol Spectrosc, 2025, 343:126602] | PubMed: 40582029 |
| Sensitizing cholangiocarcinoma to chemotherapy by inhibition of the drug-export pump MRP3 [ Biomed Pharmacother, 2024, 180:117533] | PubMed: 39405909 |
| Efficacy of futibatinib, an irreversible fibroblast growth factor receptor inhibitor, in FGFR-altered breast cancer [ Sci Rep, 2023, 13(1):20223] | PubMed: 37980453 |
| CREB3L2-ATF4 heterodimerization defines a transcriptional hub of Alzheimer's disease gene expression linked to neuropathology [ Sci Adv, 2023, 9(9):eadd2671] | PubMed: 36867706 |
| Efeito do tratamento TKI-258 sobre a expressão gênica de seus receptores-alvo e ativação de suas efetoras GTPases Rho em carcinoma epidermoide oral in vitro. [ UFTM, 2023, ] | PubMed: none |
| A community challenge for a pancancer drug mechanism of action inference from perturbational profile data [ Cell Rep Med, 2022, 3(1):100492] | PubMed: 35106508 |
| EGFR-phosphorylated GDH1 harmonizes with RSK2 to drive CREB activation and tumor metastasis in EGFR-activated lung cancer [ Cell Rep, 2022, 41(11):111827] | PubMed: 36516759 |
| Comprehensive drug response profiling and pan-omic analysis identified therapeutic candidates and prognostic biomarkers for Asian cholangiocarcinoma [ iScience, 2022, 25(10):105182] | PubMed: 36248745 |
| Lysine acetylation restricts mutant IDH2 activity to optimize transformation in AML cells [ Mol Cell, 2021, S1097-2765(21)00507-4] | PubMed: 34289383 |
| Targeting fibroblast growth factor receptors to combat aggressive ependymoma [ Acta Neuropathol, 2021, 10.1007/s00401-021-02327-x] | PubMed: 34046693 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
