Données techniques
| Formule | C24H25ClFN5O3 |
||||||
| Poids moléculaire | 485.94 | Numéro CAS | 267243-28-7 | ||||
| Solubilité (25°C)* | In vitro | Ethanol | 9 mg/mL (18.52 mM) | ||||
| DMSO | 2 mg/mL (4.11 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | Canertinib (CI-1033, PD183805) est un inhibiteur pan-ErbB ciblant EGFR et ErbB2 avec des valeurs d'IC50 de 1,5 nM et 9,0 nM, respectivement. Il ne montre aucune activité contre PDGFR, FGFR, InsR, PKC ou CDK1/2/4. Ce composé a atteint la phase 3 des essais cliniques. | ||||
|---|---|---|---|---|---|
| Cibles |
|
||||
| In vitro | Canertinib (CI-1033) montre une excellente puissance pour l'inhibition irréversible de l'autophosphorylation de l'erbB2 dans les cellules MDA-MB 453, et démontre également une perméabilité élevée dans les cellules Caco-2. Ce composé seul supprime significativement les Akt et MAP kinase constitutivement activées, et en combinaison inhibe Akt tout en empêchant l'augmentation des niveaux de phosphorylation de la MAPK. Il stimule l'expression de p27 et la phosphorylation de p38 dans les cellules MDA-MB-453. Le CI-1033 est très spécifique à la famille des récepteurs erbB et n'est pas sensible au PGFR, FGFR ou IR même à 50 μM. Il montre des niveaux élevés d'inhibition dans les cellules A431 exprimant l'EGFR avec une IC50 de 7,4 nM, et supprime la phosphorylation de la tyrosine de l'erbB2, de l'erbB3 et de l'erbB4 stimulée par l'héréguline avec des IC50 de 5, 14 et 10 nM, respectivement. Le composé inhibe également l'expression de pp62c-fos en réponse à l'héréguline. Il est prédit de modifier de manière covalente la Cys773 au sein du site de liaison de l'ATP de la kinase HER2 et améliore la destruction des molécules ErbB-2 matures et immatures. Ce composé induit une diminution significative de la phosphorylation mesurable des résidus tyrosine 845 et 1068 de l'EGFR, qui sont respectivement responsables de la signalisation Src et Ras/MAPK. Les résidus correspondants de Her-2, les résidus tyrosine 877 et 1248 sont déphosphorylés significativement par celui-ci à une concentration de 3 μM ou plus. CI pourrait bloquer l'internalisation de l'EGFR et augmenter le taux d'apoptose dans les cellules d'ostéosarcome primaires de manière titrable. De plus, il inhibe la prolifération des cellules TT, TE2, TE6 et TE10 significativement à 0,1 nM. |
||||
| In vivo | Canertinib (CI-1033) montre une activité impressionnante contre les xénogreffes A431 chez les souris nues à 5 mg/kg de poids corporel. Ce composé (20 à 80 mg/kg/jour) entraîne un degré élevé de régression tumorale dans les modèles de xénogreffes H125. Son administration orale provoque une inhibition marquée de la croissance dans les xénogreffes TT, TE6 et TE10 chez les souris nues, sans mort animale et <10% de perte de poids. |
||||
| Caractéristiques | Premier inhibiteur de kinase à montrer une activité irréversible et à être entré en essais cliniques (servant de modèle pour le développement ultérieur). |
Protocole (de référence)
| Test kinase : |
|
|---|---|
| Test cellulaire : |
|
| Étude animale : |
|
Références
|
Validation du produit par le client
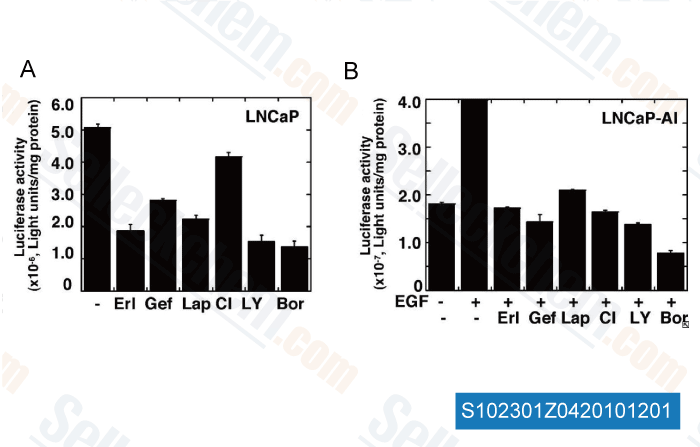
-
Données de [ Carcinogenesis , 2010 , 31, 1948–1955 ]
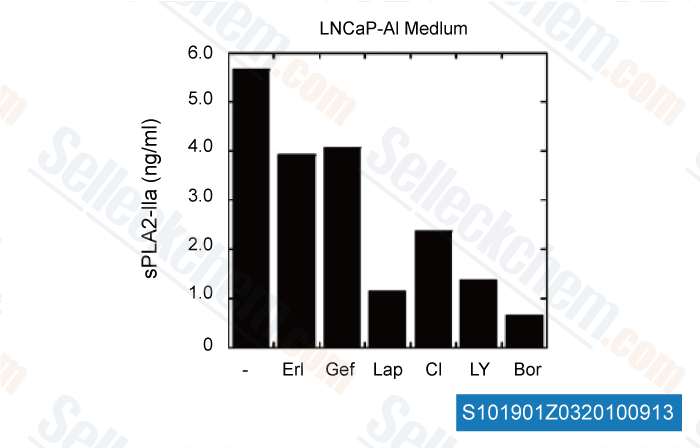
-
Données de [ Carcinogenesis , 2010 , 31, 1948–1955 ]
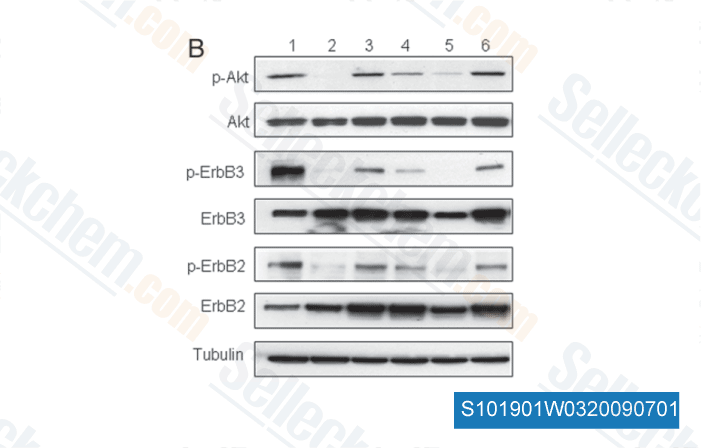
-
Données de [ Cell Cycle , 2009 , 13, 2050-2056 ]
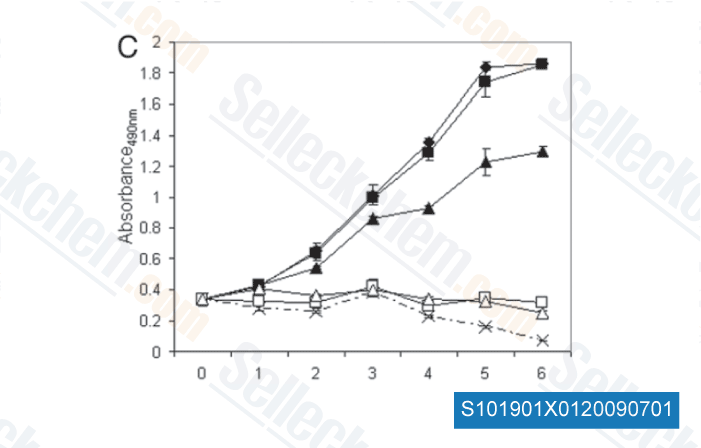
-
Données de [ Cell Cycle , 2009 , 13, 2050-2056 ]
Sellecks Canertinib (CI-1033) A été cité par 48 Publications
| Epiregulin as an Alternative Ligand for Leptin Receptor Alleviates Glucose Intolerance without Change in Obesity [ Cells, 2022, 11(3)425] | PubMed: 35159237 |
| Oncogenic fusion of BCAR4 activates EGFR signaling and is sensitive to dual inhibition of EGFR/HER2 [ Front Mol Biosci, 2022, 9:952651] | PubMed: 36081848 |
| Establishment and Characterization of NCC-PMP1-C1: A Novel Patient-Derived Cell Line of Metastatic Pseudomyxoma Peritonei [ J Pers Med, 2022, 12(2)258] | PubMed: 35207746 |
| Establishment and characterization of NCC-UPS4-C1: a novel cell line of undifferentiated pleomorphic sarcoma from a patient with Li-Fraumeni syndrome [ Hum Cell, 2022, 10.1007/s13577-022-00671-y] | PubMed: 35118583 |
| Increased Microtubule Growth Triggered by Microvesicle-mediated Paracrine Signaling is Required for Melanoma Cancer Cell Invasion [ Cancer Res Commun, 2022, 2(5):366-379] | PubMed: 36875714 |
| GCN2 kinase activation by ATP-competitive kinase inhibitors [ Nat Chem Biol, 2021, 10.1038/s41589-021-00947-8] | PubMed: 34949839 |
| Acidosis-induced activation of distal nephron principal cells triggers Gdf15 secretion and adaptive proliferation of intercalated cells [ Acta Physiol (Oxf), 2021, 10.1111/apha.13661] | PubMed: 33840159 |
| Establishment and characterization of novel patient-derived cell lines from giant cell tumor of bone [ Hum Cell, 2021, 10.1007/s13577-021-00579-z] | PubMed: 34304386 |
| Establishment and characterization of NCC-MFS4-C1: a novel patient-derived cell line of myxofibrosarcoma [ Hum Cell, 2021, 34(6):1911-1918] | PubMed: 34383271 |
| Establishment and characterization of the NCC-GCTB4-C1 cell line: a novel patient-derived cell line from giant cell tumor of bone [ Hum Cell, 2021, 10.1007/s13577-021-00639-4] | PubMed: 34731453 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
