Données techniques
| Formule | C32H29N5O2 |
||||||
| Poids moléculaire | 515.61 | Numéro CAS | 170364-57-5 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 30 mg/mL (58.18 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | Enzastaurin est un inhibiteur sélectif puissant de la PKCβ avec une IC50 de 6 nM dans les tests sans cellules, une sélectivité de 6 à 20 fois supérieure contre la PKCα, la PKCγ et la PKCε. Phase 3. | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Cibles |
|
||||||||
| In vitro | L'application d'Enzastaurin entraîne une inhibition marquée et dose-dépendante de la croissance dans toutes les lignées cellulaires de myélome multiple (MM) étudiées, y compris MM.1S, MM.1R, RPMI 8226 (RPMI), RPMI-Dox40 (Dox40), NCI-H929, KMS-11, OPM-2 et U266, avec des IC50 de 0,6 à 1,6 μM. Ce composé a un impact direct sur les cellules tumorales humaines, induisant l'apoptose et supprimant la prolifération dans les cellules tumorales cultivées. Il supprime également la phosphorylation de la GSK3βser9, de la protéine ribosomale S6S240/244 et de l'AKTThr308, sans effet direct sur la phosphorylation du VEGFR. Ce produit chimique augmente l'apoptose dans les lymphocytes malins du CTCL. Lorsqu'il est combiné à des inhibiteurs de GSK3, il a démontré une amélioration des niveaux de cytotoxicité. Le traitement combiné de ce composé et de l'inhibiteur de GSK3 AR-A014418 a entraîné une augmentation des niveaux de protéine totale β-caténine et de la transcription médiatisée par la β-caténine. Le blocage de la transcription médiatisée par la β-caténine ou le silençage par petit ARN en épingle à cheveux (shRNA) de la β-caténine a induit les mêmes effets cytotoxiques que ceux du composé combiné à l'AR-A014418. De plus, le traitement avec le composé et l'AR-A014418 a diminué les niveaux d'ARNm et l'expression de surface de CD44. |
||||||||
| In vivo | Le traitement des xénogreffes avec Enzastaurin et des radiations a produit des réductions plus importantes de la densité des microvaisseaux que chaque traitement seul. La diminution de la densité des microvaisseaux correspondait à un retard de la croissance tumorale. |
Protocole (de référence)
| Test kinase : |
|
|---|---|
| Test cellulaire : |
|
| Étude animale : |
|
Références
|
Validation du produit par le client
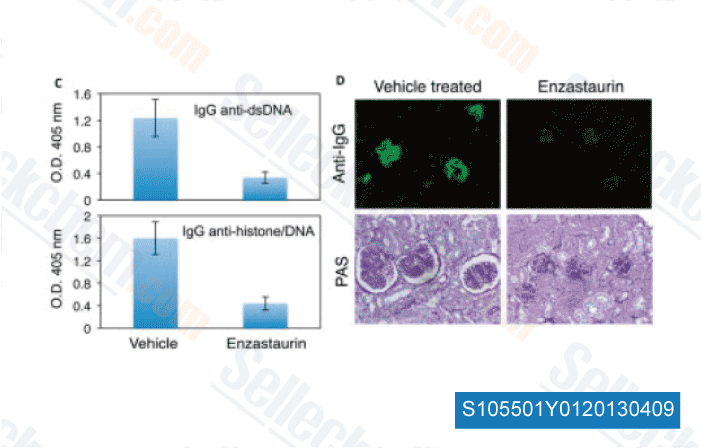
-
Données de [ Arthritis Rheum , 2013 , 65, 1022-31 ]
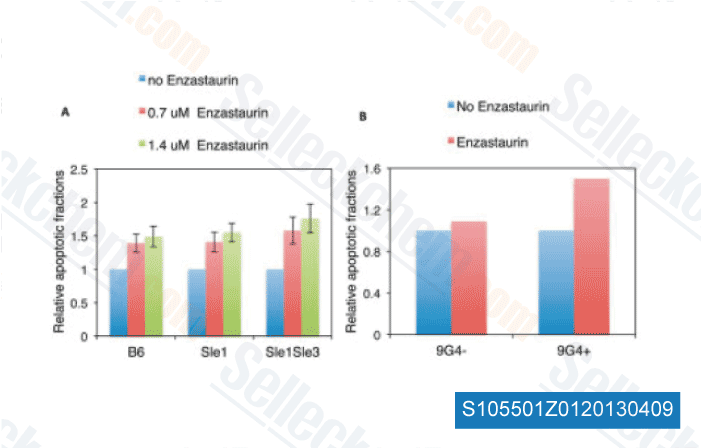
-
Données de [ Arthritis Rheum , 2013 , 65, 1022-31 ]
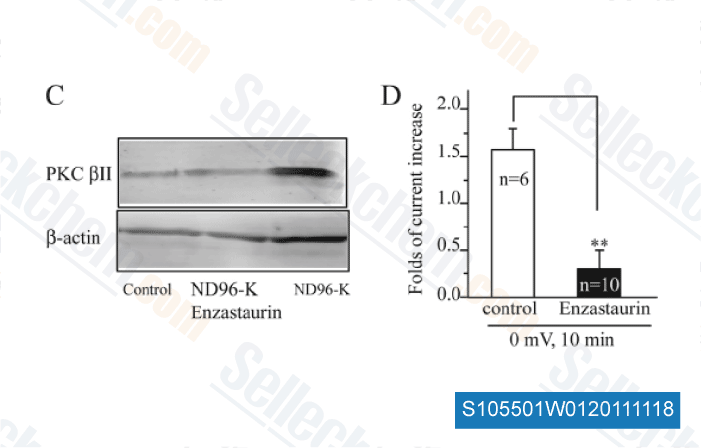
-
Données de [ J Biol Chem , 2011 , 286, 39760-7 ]
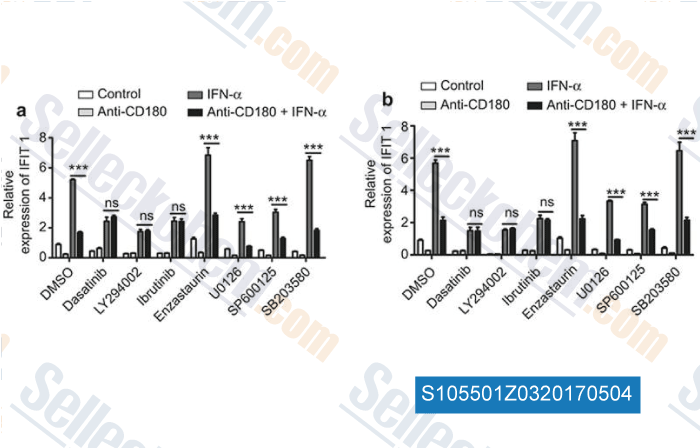
-
Données de [ , , Cell Mol Immunol, 2017, 14(2):192-202 ]
Sellecks Enzastaurin A été cité par 67 Publications
| IDH status dictates oHSV mediated metabolic reprogramming affecting anti-tumor immunity [ Nat Commun, 2025, 16(1):3874] | PubMed: 40274791 |
| Glioblastoma Tumor Microtubes and Brain Fatty Acid-binding Protein: Path to Directional Infiltration [ Neuro Oncol, 2025, noaf200] | PubMed: 40891350 |
| A patient-derived T cell lymphoma biorepository uncovers pathogenetic mechanisms and host-related therapeutic vulnerabilities [ Cell Rep Med, 2025, S2666-3791(25)00102-8] | PubMed: 40147445 |
| A genome-wide association study identified PRKCB as a causal gene and therapeutic target for Mycobacterium avium complex disease [ Cell Rep Med, 2025, S2666-3791(24)00694-3] | PubMed: 39848245 |
| Single-cell analysis reveals transcriptomic features and therapeutic targets in primary pulmonary lymphoepithelioma-like carcinoma [ Commun Biol, 2025, 8(1):394] | PubMed: 40057671 |
| Patient-derived rhabdomyosarcoma cells recapitulate the genetic and transcriptomic landscapes of primary tumors [ iScience, 2024, 27(10):110862] | PubMed: 39319271 |
| Epoxytiglianes induce keratinocyte wound healing responses via classical protein kinase C activation to promote skin re-epithelialization [ Biochem Pharmacol, 2024, 230(Pt 2):116607] | PubMed: 39489221 |
| PKCβII phosphorylates ACSL4 to amplify lipid peroxidation to induce ferroptosis [ Nat Cell Biol, 2022, 24(1):88-98] | PubMed: 35027735 |
| Targeting a splicing-mediated drug resistance mechanism in prostate cancer by inhibiting transcriptional regulation by PKCβ1 [ Oncogene, 2022, 10.1038/s41388-022-02179-z] | PubMed: 35087237 |
| Inhibition of IκB Kinase Is a Potential Therapeutic Strategy to Circumvent Resistance to Epidermal Growth Factor Receptor Inhibition in Triple-Negative Breast Cancer Cells [ Cancers (Basel), 2022, 14(21)5215] | PubMed: 36358633 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
