Données techniques
| Formule | C14H19BCl2N2O4 |
||||||
| Poids moléculaire | 361.03 | Numéro CAS | 1072833-77-2 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 72 mg/mL (199.42 mM) | ||||
| Ethanol | 72 mg/mL (199.42 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | L'Ixazomib (MLN2238) inhibe le site protéolytique (β5) de type chymotrypsine du 20S proteasome avec des IC50 et Ki de 3,4 nM et 0,93 nM respectivement dans des essais acellulaires, et inhibe également les sites protéolytiques de type caspase (β1) et de type trypsine (β2), avec des IC50 de 31 et 3500 nM. L'Ixazomib (MLN2238) induit l'autophagy. Phase 3. | ||||
|---|---|---|---|---|---|
| Cibles |
|
||||
| In vitro | À des concentrations plus élevées, ce composé inhibe également les sites protéolytiques de type caspase (β1) et de type trypsine (β2) avec une IC50 de 31 nM et 3,5 uM, respectivement. Il inhibe les cellules Calu-6 avec une IC50 de 9,7 nM. MLN2238 est un inhibiteur sélectif, puissant et réversible du Proteasome dans les cellules tumorales. Ce composé montre une inhibition réversible du Proteasome dépendante du temps. Ce composé et le Bortezomib montrent tous deux une inhibition réversible du Proteasome dépendante du temps ; cependant, la demi-vie de dissociation du Proteasome pour celui-ci est déterminée à être environ 6 fois plus rapide que celle du Bortezomib (18 et 110 minutes, respectivement). Il se dissocie plus rapidement du Proteasome que le Bortezomib, ce qui est cohérent avec une récupération plus rapide de l'activité du Proteasome observée dans l'essai Proteasome-Glo. Il a un effet pharmacodynamique tumoral global plus important que le Bortezomib, évalué par l'inhibition du 20S. Ce composé est la forme biologiquement active du MLN9708. | ||||
| In vivo | MLN2238 induit une réponse pharmacodynamique plus importante que le Bortezomib dans les tumeurs xénogreffées. Ce composé montre une inhibition maximale et soutenue du Proteasome tumoral plus importante par rapport au Bortezomib dans les modèles de xénogreffes. Ces résultats confirment que l'exposition améliorée de la tumeur observée avec cet agent se traduit par une réponse pharmacodynamique tumorale améliorée, à la fois au niveau et en aval du Proteasome. Il montre une activité antitumorale dans le modèle de xénogreffe CWR22. Ce produit chimique montre des réponses pharmacodynamiques tumorales plus importantes dans les xénogreffes WSU-DLCL2 par rapport au Bortezomib. De même, le traitement au Bortezomib n'a entraîné qu'une légère augmentation des niveaux de GADD34 dans les tumeurs xénogreffées WSU-DLCL2, alors qu'il induit fortement son expression. Ce composé présente un profil pharmacodynamique et une activité antitumorale améliorés par rapport au Bortezomib dans les modèles OCI-Ly10 et PHTX22L. | ||||
| Caractéristiques | Un inhibiteur de Proteasome de première classe qui a amélioré la pharmacocinétique (PK), la pharmacodynamique (PD) et l'activité antitumorale dans les études précliniques. |
Protocole (de référence)
| Test kinase :[1] |
|
|---|---|
| Test cellulaire :[1] |
|
| Étude animale :[2] |
|
Références
|
Validation du produit par le client
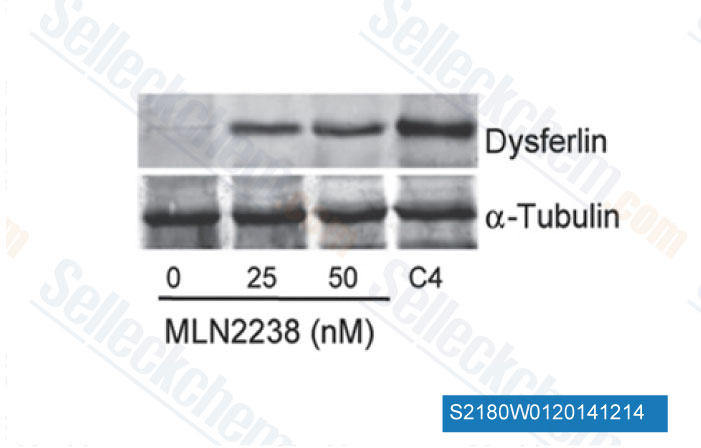
-
Données de [ Sci Transl Med , 2014 , 6(250), 250ra112 ]
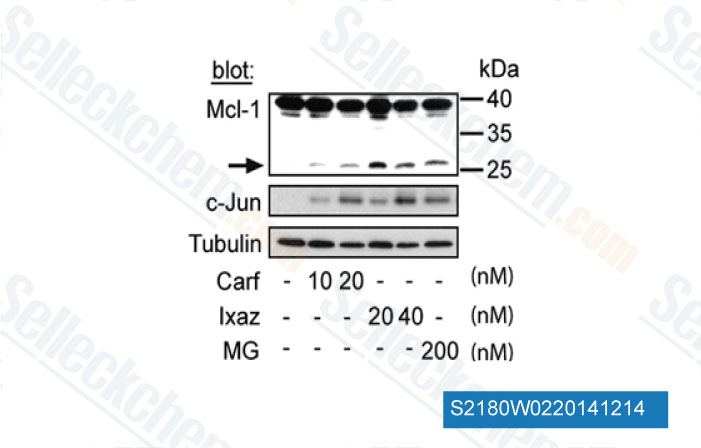
-
Données de [ Cancer Lett , 2014 , 343(2), 286-94 ]
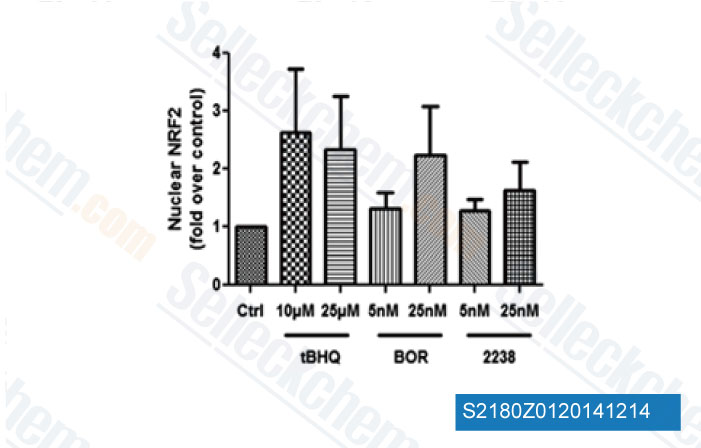
-
Données de [ Hemoglobin , 2014 , 38(3), 188-95 ]
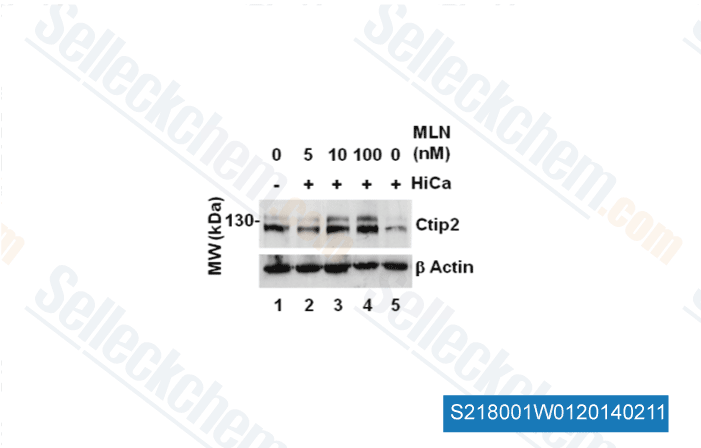
-
Données de [ J Cell Sci , 2012 , 125(Pt 23), 5733-44 ]
Sellecks MLN2238 (Ixazomib) A été cité par 71 Publications
| Structural basis for allosteric modulation of M. tuberculosis proteasome core particle [ Nat Commun, 2025, 16(1):3138] | PubMed: 40169579 |
| A patient-derived T cell lymphoma biorepository uncovers pathogenetic mechanisms and host-related therapeutic vulnerabilities [ Cell Rep Med, 2025, S2666-3791(25)00102-8] | PubMed: 40147445 |
| Enhancing T cell cytotoxicity in multiple myeloma with bispecific αPD-L1 × αCD3 T cell engager-armed T cells and low-dose bortezomib therapy [ Biomed Pharmacother, 2025, 184:117878] | PubMed: 39891948 |
| High-Throughput Drug Screening of Clear Cell Ovarian Cancer Organoids Reveals Vulnerability to Proteasome Inhibitors and Dinaciclib and Identifies AGR2 as a Therapeutic Target [ Cancer Res Commun, 2025, 5(6):1018-1033] | PubMed: 40459063 |
| Integrated transcriptomics- and structure-based drug repositioning identifies drugs with proteasome inhibitor properties [ Sci Rep, 2024, 14(1):18772] | PubMed: 39138277 |
| A combinatorial therapeutic approach to enhance FLT3-ITD AML treatment [ Cell Rep Med, 2023, 10.1016/j.xcrm.2023.101286] | PubMed: 37951217 |
| Targeting ITGB4/SOX2-driven lung cancer stem cells using proteasome inhibitors [ iScience, 2023, 26(8):107302] | PubMed: 37554452 |
| Dual inhibition of HSF1 and DYRK2 impedes cancer progression [ Biosci Rep, 2023, 43(1)BSR20222102] | PubMed: 36622366 |
| Proteasome inhibition as a therapeutic target for the fungal pathogen Cryptococcus neoformans [ Microbiol Spectr, 2023, 11(5):e0190423] | PubMed: 37750732 |
| Proteasome inhibition as a therapeutic target for the fungal pathogen Cryptococcus neoformans [ Microbiol Spectr, 2023, 10.1128/spectrum.01904-23] | PubMed: 37750732 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
