Données techniques
| Formule | C18H18N2O3 |
||||||||||
| Poids moléculaire | 310.35 | Numéro CAS | 252916-29-3 | ||||||||
| Solubilité (25°C)* | In vitro | DMSO | 62 mg/mL (199.77 mM) | ||||||||
| Water | Insoluble | ||||||||||
| Ethanol | Insoluble | ||||||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||||||
Préparation des solutions mères
Activité biologique
| Description | Orantinib (SU6668) a la plus grande puissance contre l'autophosphorylation de PDGFR avec un Ki de 8 nM dans un essai acellulaire, mais inhibe également fortement la transphosphorylation de Flk-1 et FGFR1. Il montre peu d'activité contre IGF-1R, Met, Src, Lck, Zap70, Abl et CDK2, et n'inhibe pas l'EGFR. Ce composé est en phase 3. | ||
|---|---|---|---|
| Cibles |
|
||
| In vitro | Orantinib (SU6668) est un inhibiteur compétitif, vis-à-vis de l'ATP, de la transphosphorylation de Flk-1/KDR, de la transphosphorylation de FGFR1 et de l'autophosphorylation des kinases PDGFRβ. Il (0,03-10 μM) inhibe la phosphorylation de la tyrosine de KDR dans les HUVEC stimulées par le VEGF. Ce composé inhibe également la phosphorylation de la tyrosine de PDGFRβ stimulée par le PDGF dans les cellules NIH-3T3 surexprimant PDGFRβ à une concentration minimale de 0,03-0,1 μM. Il inhibe la phosphorylation induite par le FGF acide du substrat FGFR1 2 à 10 μM et plus. Cependant, TSU-68 (jusqu'à 100 μM) n'a aucun effet sur la phosphorylation de la tyrosine de l'EGFR stimulée par l'EGF dans les cellules NIH-3T3 surexprimant l'EGFR. Il inhibe la mitogenèse des HUVEC induite par le VEGF et le FGF avec des IC50 moyennes de 0,34 μM et 9,6 μM, respectivement. Dans les cellules MO7E de leucémie myéloïde humaine, ce composé inhibe l'autophosphorylation de la tyrosine du récepteur du facteur de cellules souches (SCF), c-kit, avec une IC50 de 0,1-1 μM, ainsi que la phosphorylation d'ERK1/2, un événement de signalisation en aval de l'activation de c-kit. Il inhibe également la prolifération des cellules MO7E induite par le SCF avec une IC50 de 0,29 μM, et induit l'apoptose. | ||
| In vivo | Orantinib (SU6668) induit une inhibition de la croissance tumorale contre un large éventail de types de tumeurs dans des modèles de xénogreffes chez des souris athymiques, y compris les cellules A375, Colo205, H460, Calu-6, C6, SF763T et SKOV3TP5 à des doses de 75-200 mg/kg. Ce composé (75 mg/kg) supprime également l'angiogenèse tumorale des xénogreffes de gliome C6. Dans un modèle tumoral de carcinome colorectal humain HT29, il (200 mg/kg) diminue la perméabilité vasculaire moyenne et le volume plasmatique fractionnaire moyen dans la bordure et le cœur de la tumeur. TSU-68 favorise un développement stromal anormal à la périphérie des carcinomes. Dans un modèle de tumeur hépatique VX2 de lapin, il (200 mg/kg) augmente l'effet de la perfusion chimiothérapeutique. |
Protocole (de référence)
| Test kinase : |
|
|---|---|
| Test cellulaire : |
|
| Étude animale : |
|
Références
|
Validation du produit par le client
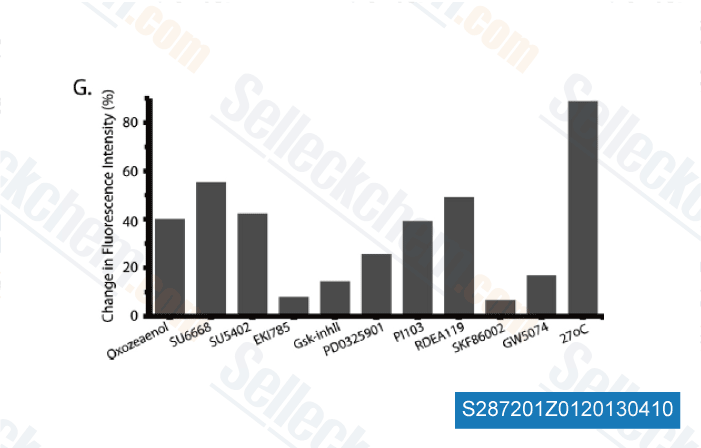
-
Données de [ Mol Cell Proteomics , 2012 ]

-
Données de [ Mol Cell Proteomics , 2012 ]
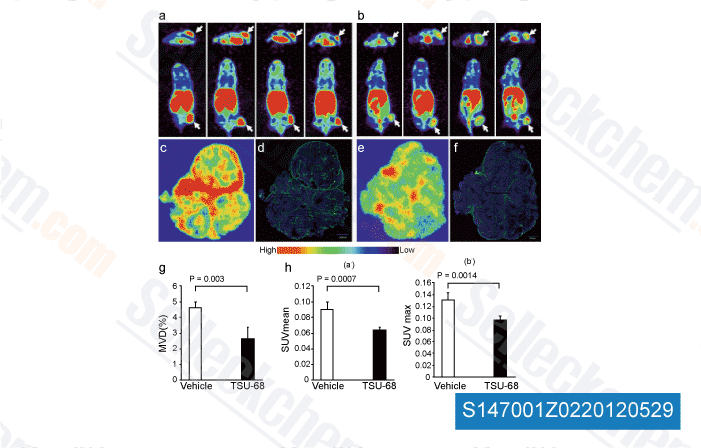
-
Données de [ Angiogenesis , 2012 , 15, 569-80 ]
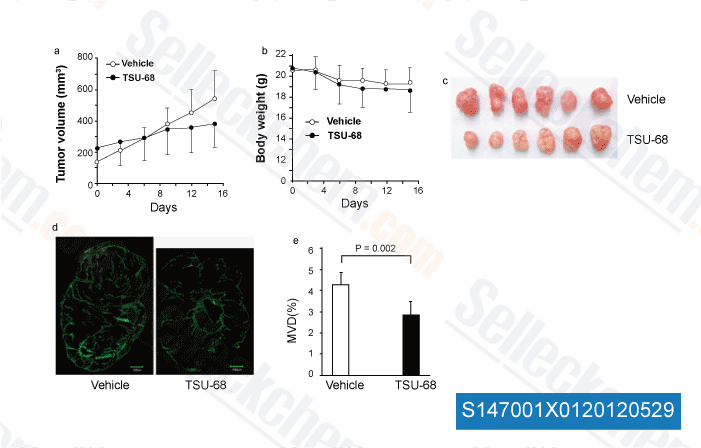
-
Données de [ Angiogenesis , 2012 , 15, 569-80 ]
Sellecks Orantinib (SU6668) A été cité par 21 Publications
| SMYD5 is a novel epigenetic gatekeeper of the mild hypothermia response [ bioRxiv, 2023, 2023.05.11.540170] | PubMed: 37333301 |
| Establishment and Characterization of NCC-PMP1-C1: A Novel Patient-Derived Cell Line of Metastatic Pseudomyxoma Peritonei [ J Pers Med, 2022, 12(2)258] | PubMed: 35207746 |
| Establishment and characterization of NCC-UPS4-C1: a novel cell line of undifferentiated pleomorphic sarcoma from a patient with Li-Fraumeni syndrome [ Hum Cell, 2022, 10.1007/s13577-022-00671-y] | PubMed: 35118583 |
| Establishment and characterization of NCC-MFS4-C1: a novel patient-derived cell line of myxofibrosarcoma [ Hum Cell, 2021, 34(6):1911-1918] | PubMed: 34383271 |
| Establishment and characterization of the NCC-GCTB4-C1 cell line: a novel patient-derived cell line from giant cell tumor of bone [ Hum Cell, 2021, 10.1007/s13577-021-00639-4] | PubMed: 34731453 |
| Establishment and characterization of novel patient-derived cell lines from giant cell tumor of bone [ Hum Cell, 2021, 10.1007/s13577-021-00579-z] | PubMed: 34304386 |
| The Meningioma Enhancer Landscape Delineates Novel Subgroups and Drives Druggable Dependencies [ Cancer Discov, 2020, CD-20-0160] | PubMed: 32703768 |
| Establishment and characterization of NCC-MFS2-C1: a novel patient-derived cancer cell line of myxofibrosarcoma [ Hum Cell, 2020, 10.1007/s13577-020-00420-z] | PubMed: 32870449 |
| Multi-omic Profiling Reveals Dynamics of the Phased Progression of Pluripotency. [ Cell Syst, 2019, 8(5):427-445] | PubMed: 31078527 |
| Intratumoural Heterogeneity Underlies Distinct Therapy Responses and Treatment Resistance in Glioblastoma. [ Cancers (Basel), 2019, 11(2)] | PubMed: 30736342 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
