Données techniques
| Formule | C19H21F2N7O2 |
||||||
| Poids moléculaire | 417.41 | Numéro CAS | 475110-96-4 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 21 mg/mL (50.31 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | ZSTK474 inhibe les isoformes de classe I de la PI3K avec une IC50 de 37 nM dans un essai sans cellules, principalement PI3Kδ. Phase 1/2. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Cibles |
|
||||||||||
| In vitro | ZSTK474 à 1 μM réduit puissamment l'activité de la PI3K à 4,7 % du niveau de contrôle, tandis que le LY2194002 ne réduit l'activité qu'à 44,6 % du contrôle. Ce composé inhibe les activités des p110β, -γ et -δ recombinantes avec des IC50 de 17 nM, 53 nM et 6 nM, respectivement. Il présente une puissante activité antiproliférative contre un panel de 39 lignées cellulaires cancéreuses humaines avec une GI50 moyenne de 0,32 μM, plus efficacement que celle du LY294002 ou de la wortmannine avec une GI50 moyenne de 7,4 μM ou 10 μM, respectivement. Ce traitement chimique à 1 μM bloque le ruffling membranaire et la génération de PIP3 induite par le facteur de croissance dérivé des plaquettes dans les fibroblastes embryonnaires murins (MEF). Il à 10 μM induit l'apoptose dans les cellules OVCAR3, et induit un arrêt complet en phase G1 mais pas l'apoptose dans les cellules A549. Ce traitement composé à 0,5 μM diminue significativement le niveau d'Akt et de GSK-3β phosphorylés, ainsi que l'expression de la protéine cycline D1. Il inhibe également la phosphorylation d'autres composants de signalisation en aval qui sont impliqués dans la régulation de la prolifération cellulaire, y compris FKHRL1, FKHR, TSC-2, mTOR et p70S6K de manière dose-dépendante. Ce produit chimique n'inhibe pas mTOR à 0,1 μM, et même à une concentration de 100 μM, il inhibe l'activité de mTOR de moins de 40 %. Il bloque la migration cellulaire induite par le VEGF et la formation de tubes dans les cellules endothéliales de la veine ombilicale humaine (HUVEC), et inhibe l'expression de HIF-1α et la sécrétion de VEGF dans les cellules RXF-631L, présentant une puissante activité antiangiogénique in vitro. Ce traitement composé inhibe la production d'IFNγ et d'IL-17 dans les lymphocytes T activés par la concanavaline A, et inhibe la prolifération et la production de PGE(2) par les cellules synoviales de type fibroblaste (FLS). |
||||||||||
| In vivo | L'administration orale de ZSTK474 inhibe la croissance des tumeurs de mélanome B16F10 de souris implantées sous-cutanément de manière dose-dépendante, produisant une régression tumorale de 28,5 %, 7,1 % ou 4,9 % au jour 14 à 100, 200 ou 400 mg/kg, respectivement, ce qui est supérieur à celui des quatre principaux médicaments anticancéreux à leurs doses maximales tolérables respectives avec une régression tumorale de 96 %, 35,7 %, 24 % ou 68,3 %, respectivement. Ce traitement composé à 400 mg/kg inhibe complètement la croissance des xénogreffes A549, PC-3 et WiDr chez la souris, et induit la régression des tumeurs xénogreffées A549. Il inhibe significativement la croissance tumorale dans le modèle de xénogreffe RXF-631L, corrélé à une réduction significative du nombre de microvaisseaux chez les souris traitées. L'administration orale de ce produit chimique améliore la progression de l'arthrite induite par l'adjuvant (AIA) chez les rats. | ||||||||||
| Caractéristiques | Premier inhibiteur de PI3K administré par voie orale utilisé in vivo. |
Protocole (de référence)
| Test kinase : |
|
|---|---|
| Test cellulaire : |
|
| Étude animale : |
|
Références
|
Validation du produit par le client
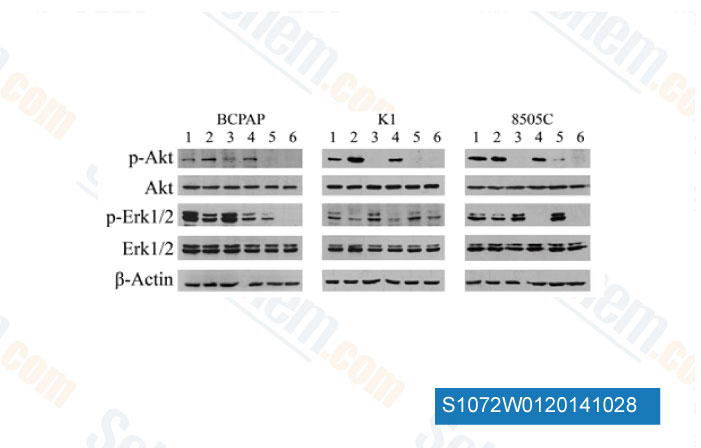
-
Données de [ Invest New Drugs , 2014 , 32(4), 626-35 ]
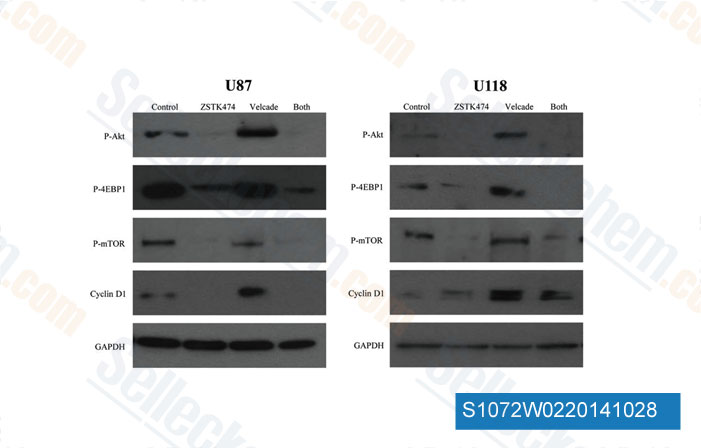
-
Données de [ Int J Oncol , 2014 , 44(2), 557-62 ]
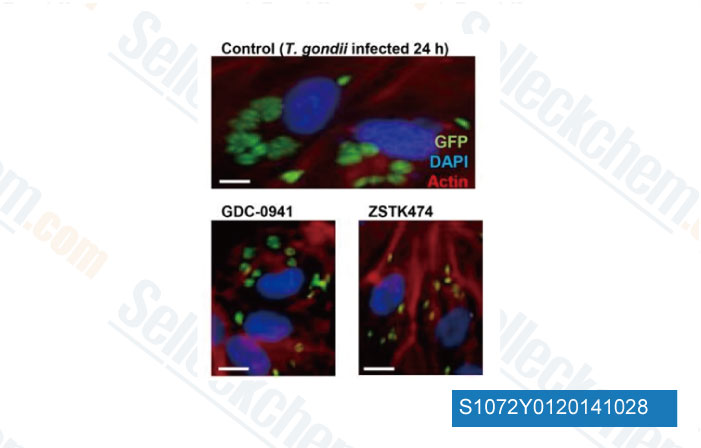
-
Données de [ PLoS One , 2013 , 8(6), e66306 ]
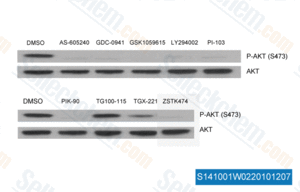
-
, , Saraswati Sukumar of Johns Hopkins University School of Medicine
Sellecks ZSTK474 A été cité par 85 Publications
| PI3K-Akt signalling regulates Scx-lineage tenocytes and Tppp3-lineage paratenon sheath cells in neonatal tendon regeneration [ Nat Commun, 2025, 16(1):3734] | PubMed: 40254618 |
| Perinatal thymic-derived CD8αβ-expressing γδ T cells are innate IFN-γ producers that expand in IL-7R-STAT5B-driven neoplasms [ Nat Immunol, 2024, 10.1038/s41590-024-01855-4] | PubMed: 38802512 |
| Perinatal thymic-derived CD8αβ-expressing γδ T cells are innate IFN-γ producers that expand in IL-7R-STAT5B-driven neoplasms [ Nat Immunol, 2024, 25(7):1207-1217] | PubMed: 38802512 |
| Reporter cell lines to screen for inhibitors or regulators of the KRAS-RAF-MEK1/2-ERK1/2 pathway [ Biochem J, 2024, 481(6):405-422] | PubMed: 38381045 |
| B cell adapter for PI 3-kinase (BCAP) coordinates antigen internalization and trafficking through the B cell receptor [ Sci Adv, 2024, 10(46):eadp1747] | PubMed: 39546610 |
| Multiplex single-cell chemical genomics reveals the kinase dependence of the response to targeted therapy [ Cell Genom, 2024, 4(2):100487] | PubMed: 38278156 |
| Stellettin B Sensitizes Glioblastoma to DNA-Damaging Treatments by Suppressing PI3K-Mediated Homologous Recombination Repair [ Adv Sci (Weinh), 2023, 10(3):e2205529] | PubMed: 36453577 |
| Young and undamaged recombinant albumin alleviates T2DM by improving hepatic glycolysis through EGFR and protecting islet β cells in mice [ J Transl Med, 2023, 21(1):89] | PubMed: 36747238 |
| HDAC Inhibition Restores Response to HER2-Targeted Therapy in Breast Cancer via PHLDA1 Induction [ Int J Mol Sci, 2023, 24(7)6228] | PubMed: 37047202 |
| Multiplex single-cell chemical genomics reveals the kinase dependence of the response to targeted therapy [ bioRxiv, 2023, 10.1101/2023.03.10.531983] | PubMed: None |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
