Données techniques
| Formule | C23H19N3O2 |
||||||||||
| Poids moléculaire | 369.42 | Numéro CAS | 905854-02-6 | ||||||||
| Solubilité (25°C)* | In vitro | DMSO | 73 mg/mL (197.6 mM) | ||||||||
| Water | Insoluble | ||||||||||
| Ethanol | Insoluble | ||||||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||||||
Préparation des solutions mères
Activité biologique
| Description | Tivantinib est le premier inhibiteur non-ATP-compétitif de c-Met avec un Ki de 0,355 μM dans un essai sans cellules, peu d'activité sur Ron, et aucune inhibition sur EGFR, InsR, PDGFRα ou FGFR1/4. Ce composé induit un arrêt en G2/M et l'apoptose. | ||
|---|---|---|---|
| Cibles |
|
||
| In vitro | Il a été démontré qu'ARQ-197 prévient les réponses cellulaires induites par HGF/c-met in vitro. Ce composé possède une activité antitumorale ; il inhibe la prolifération des cellules A549, DBTRG et NCI-H441 avec une IC50 de 0,38, 0,45, 0,29 μM. Le traitement avec cet agent entraîne une diminution de la phosphorylation de la cascade de signalisation MAPK et la prévention de l'invasion et de la migration. De plus, l'expression ectopique de c-Met dans NCI-H661, une lignée cellulaire n'ayant aucune expression endogène de c-Met, lui confère un phénotype invasif qui est également supprimé par ce produit chimique. Bien que l'ajout de concentrations croissantes de cet inhibiteur n'affecte pas significativement le Km de l'ATP, l'exposition de c-Met à 0,5 μM de cette substance a diminué la Vmax de c-Met d'environ 3 fois. La capacité de cette molécule à diminuer la Vmax sans affecter le Km de l'ATP a confirmé qu'elle inhibe c-Met par un mécanisme non-ATP-compétitif et peut donc expliquer son degré élevé de sélectivité de kinase. Elle empêche le c-Met humain recombinant avec une constante inhibitrice calculée Ki d'environ 355 nM. Bien que la concentration d'ATP la plus élevée utilisée soit de 200 μM, la puissance de ce composé contre c-Met n'est pas réduite en utilisant des concentrations d'ATP allant jusqu'à 1 mM. Il bloque la phosphorylation de c-Met et les voies de signalisation en aval de c-Met. Ce produit chimique supprime l'autophosphorylation constitutive et médiée par le ligand de c-Met et, par extension, l'activité de c-Met, entraînant à son tour l'inhibition des effecteurs en aval de c-Met. Son induction de l'apoptose dépendante des caspases est augmentée dans les cellules cancéreuses humaines exprimant c-Met, y compris les cellules HT29, MKN-45 et MDA-MB-231. |
||
| In vivo | Les trois modèles de xénogreffes traités avec Tivantinib présentent des réductions de la croissance tumorale : 66 % dans le modèle HT29, 45 % dans le modèle MKN-45 et 79 % dans le modèle MDA-MB-231. Dans ces études de xénogreffes, aucun changement significatif de poids corporel n'a été observé après administration orale de ce composé à 200 mg/kg. Sur le plan pharmacodynamique, la phosphorylation de c-Met dans les tumeurs xénogreffées de côlon humain (HT29) est fortement inhibée par ce produit chimique, comme l'indique une réduction spectaculaire de l'autophosphorylation de c-Met 24 heures après une seule dose orale de 200 mg/kg de cet agent. Cette même posologie chez la souris montre que les xénogreffes tumorales sont exposées à des niveaux plasmatiques soutenus du composé, ce qui est cohérent avec l'inhibition pharmacodynamique observée de la phosphorylation de c-Met et l'inhibition de la prolifération des lignées cellulaires cancéreuses hébergeant c-Met. Les niveaux plasmatiques de l'agent 10 heures après l'administration sont déterminés à 1,3 μM, soit plus de 3 fois la constante inhibitrice biochimique de cette substance pour c-Met. Par conséquent, il est capable de supprimer sa cible in vivo dans le tissu tumoral humain xénogreffé. En conclusion, cet inhibiteur bloque la croissance des tumeurs humaines xénogreffées dépendantes de c-Met. |
||
| Caractéristiques | Le premier inhibiteur sélectif de c-Met à être entré en essais cliniques chez l'homme. |
Protocole (de référence)
| Test kinase : |
|
|---|---|
| Test cellulaire : |
|
| Étude animale : |
|
Références
|
Validation du produit par le client
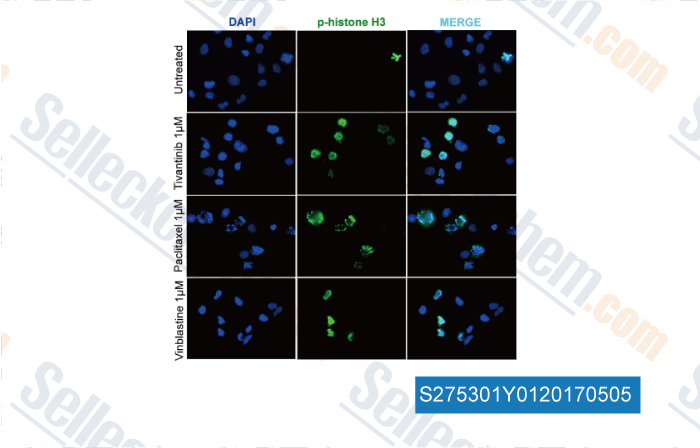
-
, , Clin Cancer Res, 2017, 23(15):4364-4375
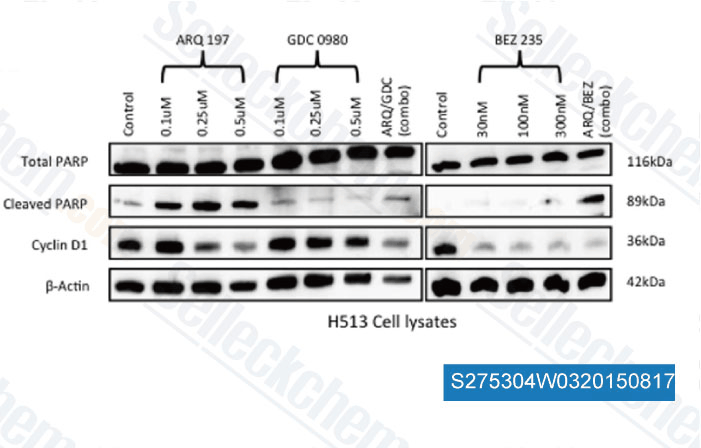
-
Données de [ , , PLoS One, 2014, 9(9): e105919 ]
Sellecks Tivantinib A été cité par 50 Publications
| MET receptor serves as a promising target in melanoma brain metastases [ Acta Neuropathol, 2024, 147(1):44] | PubMed: 38386085 |
| Insulin receptor substrate 1 is a novel member of EGFR signaling in pancreatic cells [ Eur J Cell Biol, 2024, 103(4):151457] | PubMed: 39326351 |
| EZH2/hSULF1 axis mediates receptor tyrosine kinase signaling to shape cartilage tumor progression [ Elife, 2023, 12e79432] | PubMed: 36622753 |
| A community challenge for a pancancer drug mechanism of action inference from perturbational profile data [ Cell Rep Med, 2022, 3(1):100492] | PubMed: 35106508 |
| High-Resolution Profiling of Lung Adenocarcinoma Identifies Expression Subtypes with Specific Biomarkers and Clinically Relevant Vulnerabilities [ Cancer Res, 2022, 82(21):3917-3931] | PubMed: 36040373 |
| High-resolution profiling of lung adenocarcinoma identifies expression subtypes with specific biomarkers and clinically relevant vulnerabilities [ Cancer Res, 2022, CAN-22-0432] | PubMed: 36040373 |
| Ring Finger Protein 125 Is an Anti-Proliferative Tumor Suppressor in Hepatocellular Carcinoma [ Cancers (Basel), 2022, 14(11)2589] | PubMed: 35681566 |
| Establishment and Characterization of NCC-PMP1-C1: A Novel Patient-Derived Cell Line of Metastatic Pseudomyxoma Peritonei [ J Pers Med, 2022, 12(2)258] | PubMed: 35207746 |
| MTBP enhances the activation of transcription factor ETS-1 and promotes the proliferation of hepatocellular carcinoma cells [ Front Oncol, 2022, 12:985082] | PubMed: 36106099 |
| MET Inhibition Sensitizes Rhabdomyosarcoma Cells to NOTCH Signaling Suppression [ Front Oncol, 2022, 12:835642] | PubMed: 35574376 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
