Données techniques
| Formule | C20H18ClF2N5O3 |
||||||
| Poids moléculaire | 449.84 | Numéro CAS | 1492952-76-7 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 90 mg/mL (200.07 mM) | ||||
| Ethanol | 23 mg/mL (51.12 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | Asciminib (ABL001) est un inhibiteur allostérique ABL1 puissant et sélectif avec une constante de dissociation (Kd) de 0,5-0,8 nM et une sélectivité pour la poche myristoyle d'ABL1. | ||
|---|---|---|---|
| Cibles |
|
||
| In vitro | Asciminib (ABL001) est un inhibiteur de Bcr-Abl puissant et sélectif qui maintient son activité sur la plupart des mutations, y compris T315I, avec un mécanisme d'action allostérique distinct. Il se lie à un site régulateur typiquement occupé par un groupe myristoyle dans l'ABL de type sauvage et inhibe l'activité de la kinase ABL par un mécanisme distinct de celui des inhibiteurs du site catalytique. Ce composé se lie à une poche du domaine kinase de BCR-ABL qui est normalement occupée par l'extrémité N-terminale myristoylée d'ABL1. Lors de la fusion avec BCR, cette extrémité N-terminale myristoylée qui sert à autoréguler l'activité d'ABL1 est perdue. ABL001 imite fonctionnellement le rôle de l'extrémité N-terminale myristoylée en occupant son site de liaison vacant et restaure la régulation négative de l'activité kinase. Il inhibe sélectivement la croissance des cellules de leucémie myéloïde chronique (LMC) et de LAL Ph+ dans la plage de 1-10 nM, tandis que les lignées cellulaires BCR-ABL-négatives sont restées inchangées à des concentrations 1000 fois plus élevées. Des études RMN et biophysiques confirment qu'il se lie potentiellement (constante de dissociation (Kd) = 0,5-0,8 nM) et sélectivement à la poche myristoyle d'ABL1 et induit la conformation inactive de l'hélice C-terminale. Ce composé n'a pas d'activité contre plus de 60 kinases, y compris SRC, et est également inactif contre les récepteurs couplés aux protéines G, les canaux ioniques, les récepteurs nucléaires et les transporteurs. Ainsi, il présente une sélectivité élevée. |
||
| In vivo | Dans le modèle de xénogreffe de souris KCL-22, Asciminib (ABL001) présente une activité antitumorale puissante avec une régression tumorale complète observée et une corrélation dose-dépendante claire avec l'inhibition de pSTAT5. Il a une absorption orale, un volume de distribution et une demi-vie modérés chez toutes les espèces. Ce composé, en monothérapie, induit une activité antitumorale clinique et est bien toléré à ce jour chez un sous-groupe de patients fortement prétraités atteints de leucémie myéloïde chronique. En ce qui concerne la pharmacocinétique, la pharmacodynamique et l'efficacité, les CL (clairance) sont de 12, 16 et 6 mL/min/kg chez les souris, les rats et les chiens après une dose intraveineuse unique de 1mg/kg, 2mg/kg et 1mg/kg, respectivement. Chez la souris et le chien, les T1/2term sont de 1,1 et 3,7 h après une dose i.v. unique de 1 mg/kg. Chez le rat, la T1/2term est de 2,7 h après une dose i.v. unique de 2 mg/kg. La biodisponibilité orale chez la souris et le rat est de 35 % et 27 % respectivement lorsqu'elle est administrée à 30 mg/kg p.o. Alors que chez le chien, la BA orale est de 111 % (15 mg/kg, p.o.). |
Protocole (de référence)
| Test cellulaire : |
|
|---|---|
| Étude animale : |
|
Références
|
Validation du produit par le client
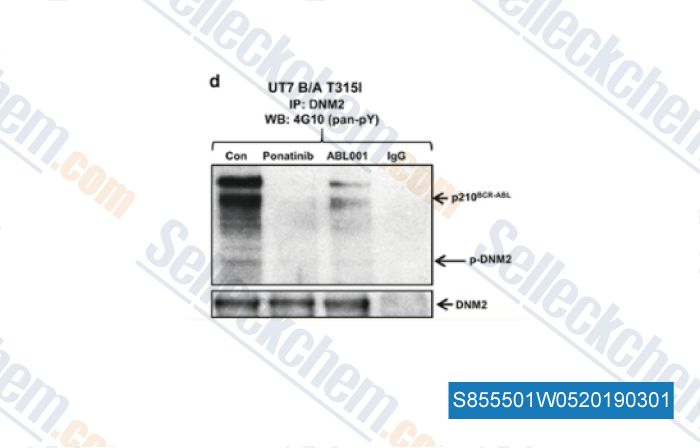
-
Données de [ , , Leukemia, 2017, 31(11):2376-2387 ]
Sellecks ABL001 (Asciminib) A été cité par 16 Publications
| Asciminib resistance of a new BCR::ABL1 p.I293_K294insSSLRD mutant detected in a Ph + ALL patient [ Ann Hematol, 2025, 10.1007/s00277-024-06142-8] | PubMed: 39774950 |
| ABL1-mediated phosphorylation promotes FOXM1-related tumorigenicity by Increasing FOXM1 stability [ Cell Death Differ, 2024, 10.1038/s41418-024-01339-w] | PubMed: 39060421 |
| The molecular basis of Abelson kinase regulation by its αI-helix [ Elife, 2024, 12RP92324] | PubMed: 38588001 |
| Asciminib Maintains Antibody-Dependent Cellular Cytotoxicity against Leukemic Blasts [ Cancers (Basel), 2024, 16(7)1288] | PubMed: 38610966 |
| Sensitivity to Tyrosine Kinase Inhibitors in a Human Philadelphia Chromosome-Positive (Ph+) Leukemia Model With the T315I-Inclusive Compound Mutation [ Cureus, 2024, 16(12):e76538] | PubMed: 39872583 |
| Effect of asciminib and vitamin K2 on Abelson tyrosine-kinase-inhibitor-resistant chronic myelogenous leukemia cells [ BMC Cancer, 2023, 23(1):827] | PubMed: 37670241 |
| Využití vybraných inhibitorů k překonání anthracyklinové rezistence v terapii nádorových onemocnění (in vitro studie). [ Charles University, 2023, ] | PubMed: None |
| Reengineering Ponatinib to Minimize Cardiovascular Toxicity [ Cancer Res, 2022, 82-15:2777-2791] | PubMed: 35763671 |
| Allosteric Inhibition of c-Abl to Induce Unfolded Protein Response and Cell Death in Multiple Myeloma [ Int J Mol Sci, 2022, 23(24)16162] | PubMed: 36555805 |
| Allosteric Inhibition of c-Abl to Induce Unfolded Protein Response and Cell Death in Multiple Myeloma [ Int. J. Mol. Sci, 2022, 23(24), 16162] | PubMed: None |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
