Données techniques
| Formule | C24H25FO5S |
||||||
| Poids moléculaire | 444.52 | Numéro CAS | 842133-18-0 | ||||
| Solubilité (25°C)* | In vitro | DMSO | 88 mg/mL (197.96 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||
Préparation des solutions mères
Activité biologique
| Description | Canagliflozin (TA 7284, JNJ 28431754) est un inhibiteur de SGLT2 très puissant et sélectif pour hSGLT2 avec une IC50 de 2,2 nM dans un essai sans cellules, présentant une sélectivité 413 fois supérieure à hSGLT1. | ||||||
|---|---|---|---|---|---|---|---|
| Cibles |
|
||||||
| In vitro | Canagliflozin (JNJ 28431754) est un nouveau C-glucoside avec un cycle thiophène. Il inhibe l'absorption de 14C-AMG dépendante du Na+ de manière concentration-dépendante. Ce composé inhibe l'absorption de 14C-AMG dans les cellules CHO-hSGLT1 et mSGLT1 avec des IC50 de 0,7 μM et >1 μM, respectivement. Il inhibe l'absorption facilitée (non liée au Na+) de 2H-2-DG médiée par GLUT dans les myoblastes L6 de moins de 50 %. Dans les ovocytes sham-injectés, Canagliflozin (10 μM) ou phlorizine (3 mM) seuls en présence de 50 μM de DNJ n'affectent pas les courants. Dans les ovocytes injectés avec SGLT3, le DMSO et Canagliflozin 10 μM inhibent les courants induits par le DNJ de 15,6 % et 23,4 %, respectivement. | ||||||
| In vivo | Canagliflozin (JNJ 28431754) montre des effets anti-hyperglycémiques prononcés chez les souris KK nourries avec un régime riche en graisses (HF-KK). L'administration orale de ce composé à 30 mg/kg à des rats SD mâles induit une excrétion de glucose sur 24 heures de 3 696 mg pour 200 g de poids corporel. Les études pharmacocinétiques révèlent une exposition beaucoup plus élevée après administration orale. Après des doses intraveineuses et orales de 3 et 10 mg/kg, respectivement, chez des rats SD mâles, l'AUC0−inf, po, t1/2 et la biodisponibilité orale sont déterminées à 35 980 ng·h/mL, 5,2 heures et 85 %, respectivement. Ainsi, l'inhibition de SGLT2 dans les tubules rénaux après administration orale est susceptible de supprimer continuellement la réabsorption du glucose. L'UGE étendue reflèterait d'excellentes propriétés pharmacocinétiques in vivo ainsi qu'une puissance élevée de l'inhibition de SGLT2. Étant donné que la majeure partie du glucose filtré est réabsorbée par SGLT2 dans les tubules rénaux, ce nouveau composé serait utile comme agent antidiabétique. Une administration orale unique à 3 mg/kg a remarquablement réduit les niveaux de glucose sanguin sans influencer la prise alimentaire chez les souris KK hyperglycémiques nourries avec un régime riche en graisses (HF-KK). Il y a une réduction de 48 % du niveau de glucose sanguin par rapport au véhicule à 6 heures. En revanche, il n'affecte que légèrement les niveaux de glucose sanguin chez les souris normoglycémiques. Par conséquent, Canagliflozin contrôlerait l'hyperglycémie dans le traitement du DT2 avec un faible risque d'hypoglycémie. |
Protocole (de référence)
| Test cellulaire :[1] |
|
|---|---|
| Étude animale :[2] |
|
Références
|
Validation du produit par le client

-
Données de [ , , Mol Metab, 2016, 5(10):1048-56 ]
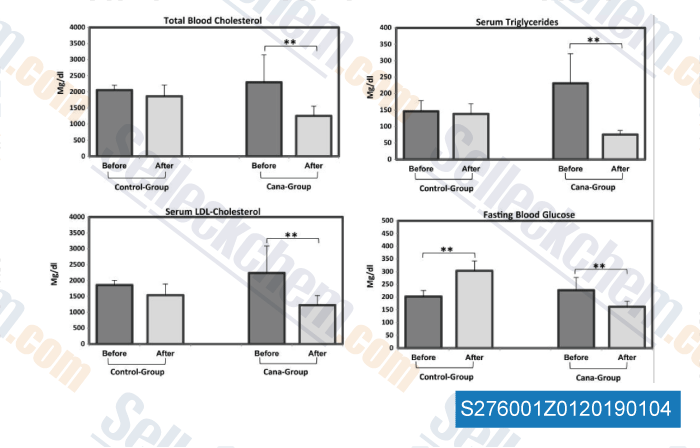
-
Données de [ , , Cardiovasc Diabetol, 2018, 17(1):106 ]
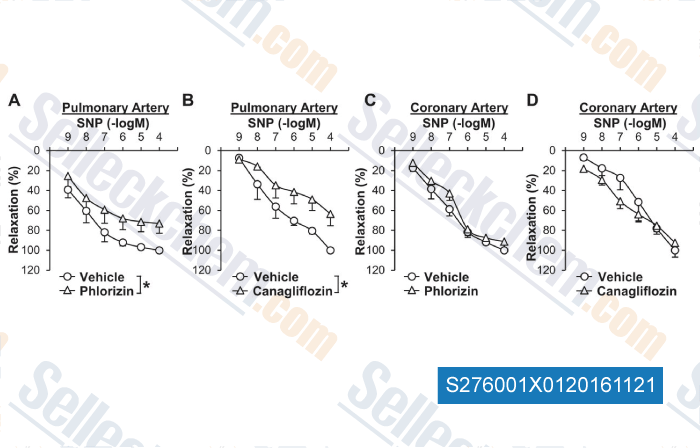
-
Données de [ , , Am J Physiol Lung Cell Mol Physiol, 2015, 309(9):L1027-36. ]
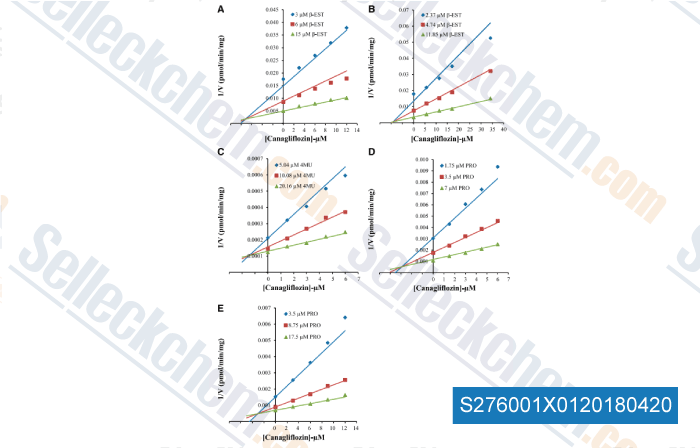
-
Données de [ , , Drug Metab Dispos, 2015, 43(10):1468-76. ]
Sellecks Canagliflozin (JNJ-28431754) A été cité par 34 Publications
| Nuclear translocation of metabolic enzyme PKM2 participates in high glucose-promoted HCC metastasis by strengthening immunosuppressive environment [ Redox Biol, 2024, 71:103103] | PubMed: 38471282 |
| Canagliflozin reverses doxorubicin-induced cardiotoxicity via restoration of autophagic homeostasis [ Toxicol Appl Pharmacol, 2024, 495:117183] | PubMed: 39631538 |
| Canagliflozin primes antitumor immunity by triggering PD-L1 degradation in endocytic recycling [ J Clin Invest, 2023, 133(1)e154754] | PubMed: 36594471 |
| Canagliflozin ameliorates hypobaric hypoxia-induced pulmonary arterial hypertension by inhibiting pulmonary arterial smooth muscle cell proliferation [ Clin Exp Hypertens, 2023, 10.1080/10641963.2023.2278205] | PubMed: 37970663 |
| The impact of SGLT2 inhibitors on αKlotho in renal MDCK and HK-2 cells [ Front Endocrinol (Lausanne), 2023, 14:1069715] | PubMed: 36967770 |
| Study on the pharmacological mechanisms of sodium-glucose co-transporter 2 inhibitors in obesity-related atrial fibrillation based on network pharmacology and experimental verification [ Ann Transl Med, 2023, 11(8):300] | PubMed: 37181345 |
| Systematic identification of biomarker-driven drug combinations to overcome resistance [ Nat Chem Biol, 2022, 10.1038/s41589-022-00996-7] | PubMed: 35332332 |
| SGLT2 inhibitor activates the STING/IRF3/IFN-β pathway and induces immune infiltration in osteosarcoma [ Cell Death Dis, 2022, 13(6):523] | PubMed: 35662245 |
| Multi-site desmoplastic small round cell tumors are genetically related and immune-cold [ Cell Mol Life Sci, 2022, 79(5):273] | PubMed: 35503137 |
| Anti-inflammatory effect of SGLT-2 inhibitors viauric acidand insulin [ Cellular and Molecular Life Sciences, 2022, 273] | PubMed: None |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
