Données techniques
| Formule | C6H6N6O2 |
||||||||||
| Poids moléculaire | 194.15 | Numéro CAS | 85622-93-1 | ||||||||
| Solubilité (25°C)* | In vitro | DMSO | 39 mg/mL (200.87 mM) | ||||||||
| Water | 5 mg/mL (25.75 mM) | ||||||||||
| Ethanol | Insoluble | ||||||||||
| In vivo (Ajouter les solvants au produit individuellement et dans lordre.) |
|
||||||||||
|
* <1 mg/ml signifie légèrement soluble ou insoluble. * Veuillez noter que Selleck teste la solubilité de tous les composés en interne, et la solubilité réelle peut différer légèrement des valeurs publiées. Ceci est normal et est dû à de légères variations dun lot à lautre. * Expédition à température ambiante (les tests de stabilité montrent que ce produit peut être expédié sans aucune mesure de refroidissement.) |
|||||||||||
Préparation des solutions mères
Activité biologique
| Description | Le témozolomide (TMZ) est un agent alkylant monofonctionnel SN-1 qui peut modifier les atomes d'azote dans l'anneau d'ADN et le groupe oxygène extracyclique, chimiquement converti en MTIC et se dégrade en cation méthyldiazonium, qui transfère les groupes méthyle à l'ADN au pH physiologique. C'est un inducteur de dommages à l'ADN dans les cellules L-1210 et L-1210/BCNU. Ce composé induit l'apoptose et présente une activité antitumorale. | |
|---|---|---|
| Cibles |
|
|
| In vitro | Le témozolomide (TMZ) provoque la formation de sites labiles aux alcalis dans l'ADN qui sont présents en quantités similaires et réparés à un taux similaire dans les lignées cellulaires L-1210 et L-1210/BCNU. Dans les cellules L-1210 mais pas dans les cellules L-1210/BCNU, ce composé induit un arrêt des cellules dans les phases SL-G2-M. Sa sensibilité des cellules chimiosensibles et résistantes (D54-R et U87-R) est significativement améliorée sous hyperoxie. Le témozolomide et l'hyperoxie sont associés à une phosphorylation accrue de l'ERK p44/42 MAPK (Erk1/2), mais à un moindre degré dans les cellules D54-R, suggérant que l'activité d'Erk1/2 pourrait être impliquée dans la régulation de l'hyperoxie et de la mort cellulaire médiée par le TMZ. L'hyperoxie améliore sa toxicité dans les cellules de GBM par induction de l'apoptose, possiblement via les voies liées aux MAPK. Il induit dans les monocytes les voies de réponse aux dommages à l'ADN ATM-Chk2 et ATR-Chk1, ce qui entraîne l'activation de p53. L'exposition chronique à ce composé entraîne une résistance acquise au TMZ et élève l'expression de miR-21. Le traitement avec ce composé déclenche un stress du réticulum endoplasmique (RE) avec une expression accrue des protéines GADD153 et GRP78, et diminue la protéine pro-caspase 12. Il induit l'Autophagy par des mécanismes dépendants des dommages mitochondriaux et du stress du RE pour protéger les cellules de gliome. |
|
| In vivo | Après une dose quotidienne i.p. de 40 mg/kg pendant 5 jours consécutifs (jours 1-5 après la greffe tumorale), le TMZ (Temozolomide) augmente la durée de vie de 86% chez L-1210 et de 22% chez L-1210/BCNU. Chez L-1210/BCNU, aucun effet n'est observé après un traitement de 100 μM ou 200 μM ; seulement 400 μM de ce composé ont produit une accumulation de cellules en phase prémétotique, mais beaucoup moins que chez L-1210. Chez L-1210/BCNU, l'accumulation maximale de cellules en SL-G2-M est, après 48 heures-72 heures, d'environ 30% par rapport à 23% dans les cellules non traitées. L'accumulation de cellules en SL-G2-M s'est également produite lorsque des souris porteuses de leucémie L-1210 ont été traitées i.v. avec ce composé (40 mg/kg). Aucun effet similaire n'est observé sur les cellules L-1210/BCNU de souris ayant reçu la même dose de médicament. |
|
| Caractéristiques | Le méthazolastone est un agent alkylant de seconde génération. |
Protocole (de référence)
| Test cellulaire : |
|
|---|---|
| Étude animale : |
|
Références
|
Validation du produit par le client
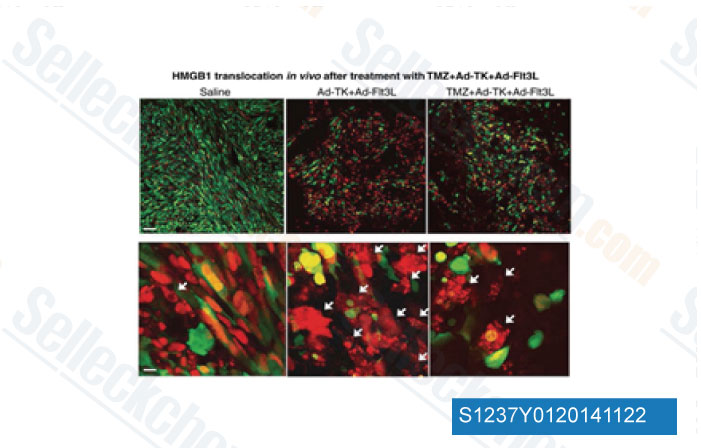
-
Données de [ Clin Cancer Res , 2014 , 20(6), 1555-65 ]
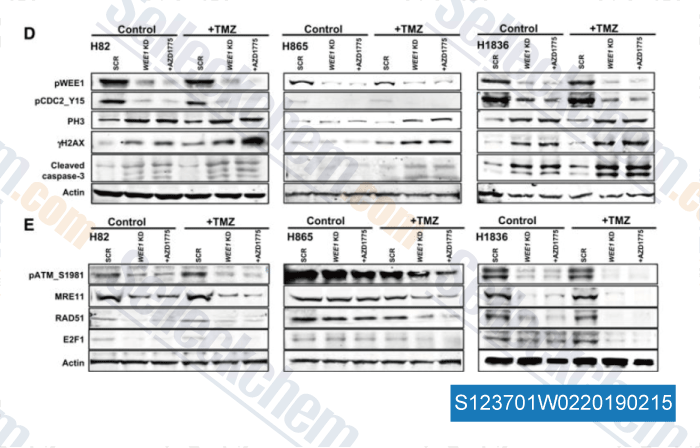
-
Données de [ , , Clin Cancer Res, 2017, 23(20):6239-6253 ]
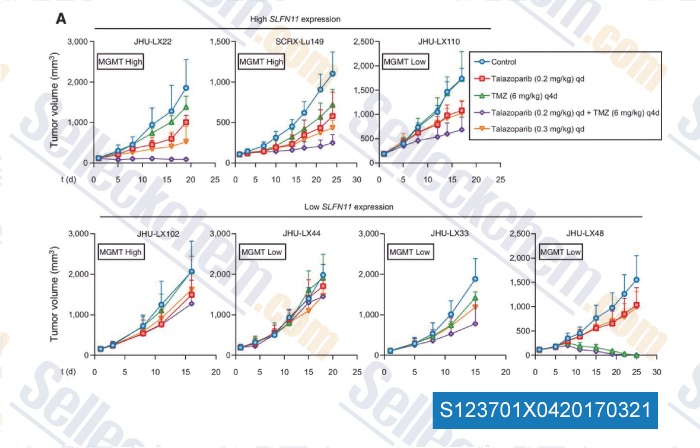
-
Données de [ , , Clin Cancer Res, 2017, 23(2):523-535 ]
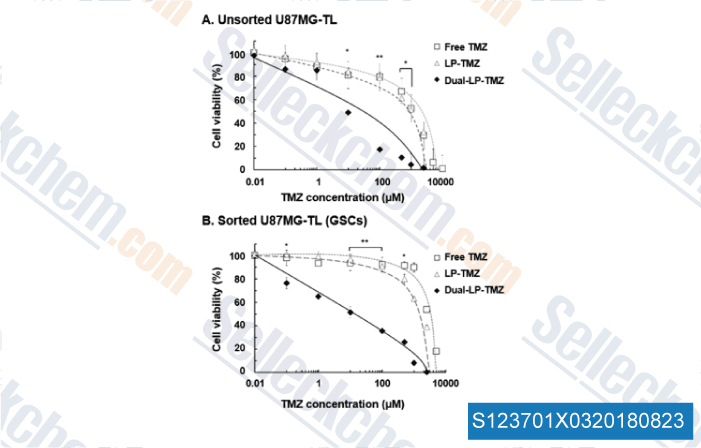
-
Données de [ , , J Control Release, 2018, 269:245-257 ]
Sellecks TMZ(Temozolomide) A été cité par 254 Publications
| Proteogenomic characterization of non-functional pancreatic neuroendocrine tumors unravels clinically relevant subgroups [ Cancer Cell, 2025, 43(4):776-796.e14] | PubMed: 40185092 |
| Cisplatin and temozolomide combinatorial treatment triggers hypermutability and immune surveillance in experimental cancer models [ Cancer Cell, 2025, S1535-6108(25)00223-5] | PubMed: 40513578 |
| Multidimensional third-generation sequencing of modified DNA bases allows interrogation of complex biological systems [ Nat Commun, 2025, 16(1):5676] | PubMed: 40593667 |
| HR eye & MMR eye: one-day assessment of DNA repair-defective tumors eligible for targeted therapy [ Nat Commun, 2025, 16(1):4239] | PubMed: 40355434 |
| A cancer persistent DNA repair circuit driven by MDM2, MDM4 (MDMX), and mutant p53 for recruitment of MDC1 and 53BP1 on chromatin [ Nucleic Acids Res, 2025, 53(13)gkaf627] | PubMed: 40626562 |
| Calnexin promotes glioblastoma progression by inducing protective mitophagy through the MEK/ERK/BNIP3 pathway [ Theranostics, 2025, 15(6):2624-2648] | PubMed: 39990231 |
| Overexpression of miR-124 enhances the therapeutic benefit of TMZ treatment in the orthotopic GBM mice model by inhibition of DNA damage repair [ Cell Death Dis, 2025, 16(1):47] | PubMed: 39865088 |
| Transketolase attenuates the chemotherapy sensitivity of glioma cells by modulating R-loop formation [ Cell Rep, 2025, 44(1):115142] | PubMed: 39792560 |
| CDK12 regulates cellular metabolism to promote glioblastoma growth [ JCI Insight, 2025, 10(21)e190780] | PubMed: 40996961 |
| EZH2 inhibition sensitizes MYC-high medulloblastoma cancers to PARP inhibition by regulating NUPR1-mediated DNA repair [ Oncogene, 2025, 44(6):391-405] | PubMed: 39562655 |
POLITIQUE DE RETOUR
La politique de retour inconditionnelle de Selleck Chemical garantit une expérience dachat en ligne fluide à nos clients. Si vous nêtes en aucun cas satisfait de votre achat, vous pouvez retourner tout article dans les 7 jours suivant sa réception. En cas de problèmes de qualité du produit, quil sagisse de problèmes liés au protocole ou au produit, vous pouvez retourner tout article dans les 365 jours suivant la date dachat initiale. Veuillez suivre les instructions ci-dessous lors du retour des produits.
EXPÉDITION ET STOCKAGE
Les produits Selleck sont transportés à température ambiante. Si vous recevez le produit à température ambiante, soyez assuré que le service dinspection de la qualité de Selleck a mené des expériences pour vérifier que le placement à température normale pendant un mois naffectera pas lactivité biologique des produits en poudre. Après réception, veuillez stocker le produit conformément aux exigences décrites dans la fiche technique. La plupart des produits Selleck sont stables dans les conditions recommandées.
NON DESTINÉ À UN USAGE HUMAIN, VÉTÉRINAIRE DIAGNOSTIQUE OU THÉRAPEUTIQUE.
