pour la recherche uniquement
NH125 CaMK inhibiteur
Réf. CatalogueS7436
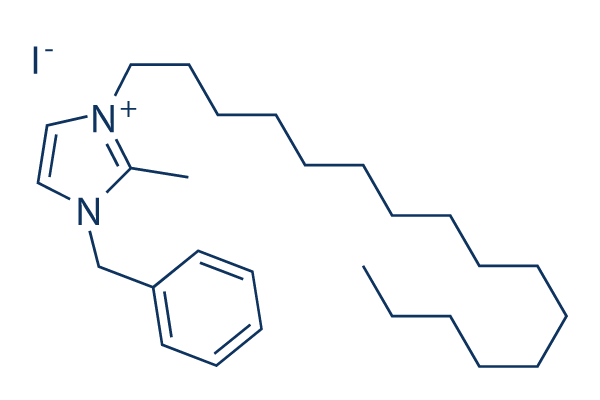
Structure chimique
Poids moléculaire: 524.56
Contrôle Qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- SDS
- Fiche technique
| Cibles apparentées | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Histamine Receptor Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) |
|---|---|
| Autre CaMK Inhibiteurs | KN-93 Phosphate KN-93 STO-609 KN-62 KN-92 phosphate KN-93 hydrochloride |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 524.56 | Formule | C27H45IN2 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 278603-08-0 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CCCCCCCCCCCCCCCCN1C=C[N+](=C1C)CC2=CC=CC=C2.[I-] | ||
Solubilité
|
In vitro |
DMSO
: 100 mg/mL
(190.63 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
eEF-2 kinase
60 nM
|
|---|---|
| In vitro |
Dans les cellules de gliome C6, NH125 diminue le contenu cellulaire de phospho-eEF-2 sans affecter le contenu total d'eEF-2, et bloque le transit du cycle cellulaire à la limite G1-S. Ce composé inhibe puissamment la viabilité cellulaire de 10 cellules cancéreuses avec des IC50 allant de 0,7 à 4,8 μM. Il inhibe efficacement les histidine protéines kinases, y compris Envz, PhoQ, BvgS, EvgS, et produit ainsi de puissantes activités antibactériennes sur Staphylococcus aureus résistant à l'oxacilline (ORSA), Enterococcus faecalis résistant à la vancomycine (VRE), Streptococcus pneumoniae résistant à la pénicilline (PRS) et d'autres bactéries Gram-positives et Gram-négatives. L'inhibition de l'EEF2K par ce produit chimique rend les cellules tumorales plus sensibles à la curcumine et au velcade, qui possèdent une action inductrice de stress du RE.
|
| Essai kinase |
Essai de l'eEF-2 Kinase
|
|
L'activité de l'eEF-2 kinase est mesurée par deux méthodes : (a) un essai basé sur filtre ; et (b) par immunobuvardage utilisant un anticorps anti-phospho-eEF2. Pour ces deux méthodes, les réactions sont réalisées dans un volume total de 20 μl contenant 50 mM HEPES (pH 7,5), 10 mM MgCl2, 1,5 mM CaCl2, 100 μg/ml de calmoduline, 2 μM d'eEF-2 étiqueté His et 400 nM de GST-eEF-2 kinase, et un mélange d'ATP [50 μM d'ATP avec 1 μCi (γ-33P)ATP]. Le mélange de kinase sans ATP est préparé sur glace puis préincubé pendant 15 min à température ambiante. Les réactions de kinase sont démarrées par l'ajout d'ATP et laissées à progresser à 30°C pendant 30 min. Pour l'essai basé sur filtre, la réaction est arrêtée par l'ajout de 20 μl d'acide phosphorique froid à 1,5%, et 5 μl de la réaction sont appliqués sur du papier phosphocellulose P81 Whatman. Le papier est lavé trois fois dans 500 ml d'acide phosphorique à 0,5% et une fois avec 200 ml d'acétone. Le papier est ensuite séché à l'air libre et immergé dans 10 ml de mélange de scintillation. La radioactivité est comptée à l'aide d'un compteur à scintillation liquide Beckton-Dickinson. Pour l'immunobuvardage, les réactions sont arrêtées par l'ajout de 20 μl de tampon Lamelli 3× [190 mM Tris (pH 6,8), 6% SDS, 30% glycérol, 15% 2-mercaptoéthanol et 0,003% de bleu de bromphénol]. Les échantillons sont bouillis pendant 5 min et résolus par SDS-PAGE à 7% et traités pour le Western blotting comme décrit ci-dessous. Les conditions pour les deux essais sont choisies pour assurer la linéarité de la réaction par rapport au temps d'incubation et à la concentration d'enzyme.
|
|
| In vivo |
NH125 réduit la pression artérielle chez les SHR et la production de ROS, l'induction de molécules inflammatoires et l'hypertrophie dans l'artère mésentérique supérieure des SHR.
|
Références |
|
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
