pour la recherche uniquement
(+)-Borneol GABA Receptor modulateur
Réf. CatalogueS3959
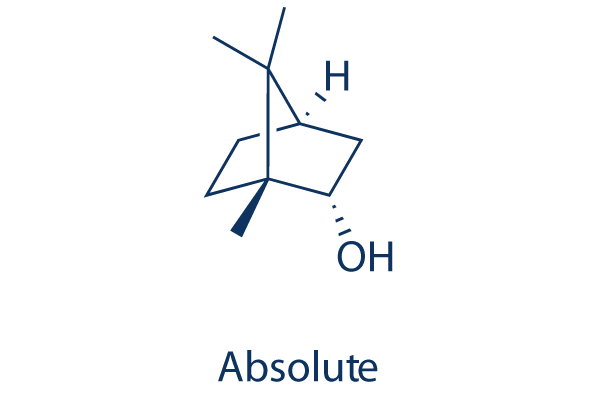
Structure chimique
Poids moléculaire: 154.25
Contrôle Qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- SDS
- Fiche technique
| Cibles apparentées | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Histamine Receptor Dopamine Receptor TRP Channel Cholinesterase (ChE) GluR |
|---|---|
| Autre GABA Receptor Inhibiteurs | Dihydromyricetin CGP52432 Oxiracetam Ginkgolide A Pentylenetetrazol 4-Aminobutyric acid (GABA) Emamectin Benzoate Nefiracetam Piracetam Bemegride |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 154.25 | Formule | C10H18O |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 464-43-7 | -- | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CC1(C2CCC1(C(C2)O)C)C | ||
Solubilité
|
In vitro |
DMSO
: 30 mg/mL
(194.48 mM)
|
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| In vitro |
Le (+)-borneol inhibe significativement l'expression de l'iNOS et du TNF-α de manière dose-dépendante dans les cellules BV-2 stimulées par le LPS. La cytotoxicité cellulaire induite par l'Aβ est inhibée par un traitement à 100 μM de (−) et (+) borneol. Le traitement au borneol diminue significativement la production de ROS. L'expression de HO-1 et la translocation nucléaire de Nrf2 sont augmentées par le traitement à l'Aβ. Cette translocation nucléaire de Nrf2 est davantage augmentée par l'administration de borneol. Comparé au groupe traité à l'Aβ, le groupe traité au (+) borneol augmente significativement l'expression de Bcl-2 avec une diminution de l'expression de Bax. Ainsi, le Borneol protège les cellules SH-SY5Y contre la toxicité induite par l'Aβ, exerce un effet antioxydant et supprime l'apoptose.
|
|---|---|
| In vivo |
Dans le modèle de rat d'ischémie cérébrale permanente, le (+)-borneol (1,0 mg/kg) améliore significativement la taille de l'infarctus et les scores neurologiques en réduisant l'expression de l'oxyde nitrique synthase inductible (iNOS) et du facteur de nécrose tumorale alpha (TNF-α) de manière dose-dépendante. Notamment, le (+)-borneol montre des effets à long terme sur l'amélioration des fonctions sensorimotrices dans le modèle photothrombotique d'accident vasculaire cérébral, ce qui diminue le nombre de faux pas dans la tâche de marche sur grille et les scores d'asymétrie des membres antérieurs dans la tâche du cylindre, au moins en partie en réduisant la perte des épines dendritiques en longueur, nombre de branches et densité. Le (+)-Borneol relâche manifestement la jonction serrée intercellulaire dans la barrière hémato-encéphalique (BHE) et améliore la distribution des médicaments dans le tissu cérébral, car il pourrait augmenter le nombre et le volume des vésicules pinocytotiques dans les cellules de la BHE et ainsi favoriser le transport de substances par pinocytose cellulaire. Il contribue à la neuroprotection et réduit l'expression des cytokines pro-inflammatoires et favorise la récupération fonctionnelle après un AVC permanent avec un effet à long terme dans la phase aiguë de l'ischémie cérébrale focale permanente.
|
Références |
|
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
