pour la recherche uniquement
S-Ruxolitinib (INCB018424) JAK inhibiteur
Réf. CatalogueS2902
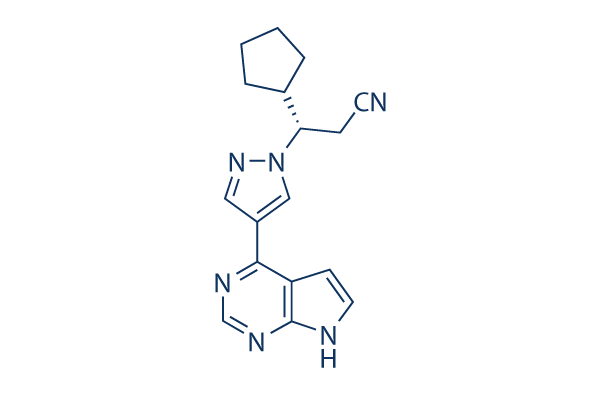
Structure chimique
Poids moléculaire: 306.37
Contrôle Qualité
| Cibles apparentées | EGFR STAT Pim |
|---|---|
| Autre JAK Inhibiteurs | BMS-986165 (Deucravacitinib) AZD1480 WP1066 Momelotinib (CYT387) Filgotinib (GLPG0634) AT9283 Gandotinib (LY2784544) Pacritinib TG101209 Cerdulatinib (PRT062070) hydrochloride |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 306.37 | Formule | C17H18N6 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 941685-37-6 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | C1CCC(C1)C(CC#N)N2C=C(C=N2)C3=C4C=CNC4=NC=N3 | ||
Solubilité
|
In vitro |
DMSO
: 61 mg/mL
(199.1 mM)
Ethanol : 61 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
JAK2
(Cell-free assay) 2.8 nM
JAK1
(Cell-free assay) 3.3 nM
TYK2
(Cell-free assay) 19 nM
|
|---|---|
| In vitro |
S-Ruxolitinib (INCB018424) inhibe puissamment et sélectivement la signalisation et la prolifération médiées par JAK2V617F dans les cellules Ba/F3 et les cellules HEL. Il augmente significativement l'apoptose de manière dose-dépendante dans les cellules Ba/F3. Ce composé (64 nM) entraîne un doublement des cellules avec des mitochondries dépolarisées dans les cellules Ba/F3. Il inhibe la prolifération des progéniteurs érythroïdes de donneurs normaux et de patients atteints de polyglobulie de Vaquez avec une IC50 de 407 nM et 223 nM, respectivement. L'INCB018424 démontre une puissance remarquable contre la formation de colonies érythroïdes avec une IC50 de 67nM.
|
| Essai kinase |
Test de liaison
|
|
Les protéines recombinantes sont exprimées à l'aide de cellules Sf21 et de vecteurs de baculovirus et purifiées par chromatographie d'affinité. Les tests de kinase JAK utilisent un test de fluorescence résolue dans le temps homogène avec le substrat peptidique (-EQEDEPEGDYFEWLE). Chaque réaction enzymatique est réalisée avec S-Ruxolitinib (INCB018424) ou un contrôle, l'enzyme JAK, 500 nM de peptide, de l'adénosine triphosphate (ATP ; 1 mM) et 2% de diméthylsulfoxyde (DMSO) pendant 1 heure. La concentration inhibitrice à 50% (IC50) est calculée comme la concentration de ce composé nécessaire pour inhiber 50% du signal fluorescent.
|
|
| In vivo |
Le S2902 (180 mg/kg, par voie orale, deux fois par jour) entraîne un taux de survie supérieur à 90% au jour 22 dans un modèle de souris JAK2V617F. Le S2902 (180 mg/kg, par voie orale, deux fois par jour) réduit significativement la splénomégalie et les niveaux circulants de cytokines inflammatoires, et élimine préférentiellement les cellules néoplasiques, entraînant une survie significativement prolongée sans effets myélosuppressifs ou immunosuppressifs dans un modèle de souris JAK2V617F. Le critère d'évaluation principal est atteint chez 41,9% des patients du groupe S2902 contre 0,7% dans le groupe placebo dans l'essai en double aveugle sur la myélofibrose. Le Ruxolitinib entraîne le maintien de la réduction du volume de la rate et une amélioration de 50% ou plus du score total des symptômes. Au total, 28% des patients du groupe S2902 (15 mg deux fois par jour) présentent au moins une réduction de 35% du volume de la rate à la semaine 48 chez les patients atteints de myélofibrose, contre 0% dans le groupe recevant la meilleure thérapie disponible. La longueur moyenne palpable de la rate a diminué de 56% avec le S2902 mais a augmenté de 4% avec la meilleure thérapie disponible à la semaine 48. Les patients du groupe S2902 ont montré une amélioration des mesures globales de qualité de vie et une réduction des symptômes associés à la myélofibrose.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT06310304 | Active not recruiting | Healthy Participants |
Incyte Corporation |
March 26 2024 | Phase 1 |
| NCT02596347 | Completed | Chronic Beryllium Disease (CBD)|Beryllium Sensitization (BeS) |
National Jewish Health |
April 2015 | -- |
| NCT00617994 | Completed | Psoriasis |
Incyte Corporation |
August 31 2007 | Phase 2 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
