pour la recherche uniquement
Toremifene Citrate (NK 622) Estrogen/progestogen Receptor modulateur
Réf. CatalogueS1776
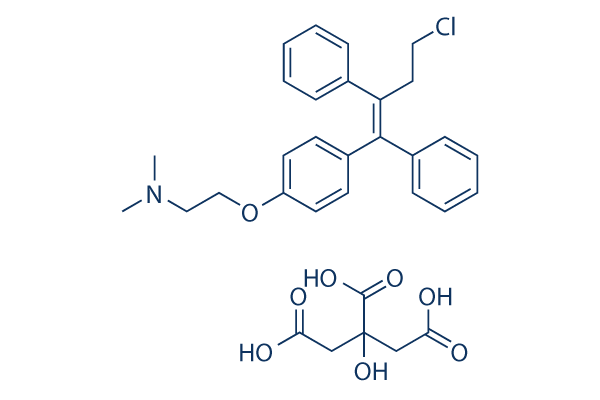
Structure chimique
Poids moléculaire: 598.08
Contrôle Qualité
| Cibles apparentées | Adrenergic Receptor GPR Androgen Receptor Glucocorticoid Receptor ACE RAAS Progesterone Receptor Opioid Receptor PGES THR |
|---|---|
| Autre Estrogen/progestogen Receptor Inhibiteurs | Elacestrant (RAD1901) Dihydrochloride Vepdegestrant (ARV-471) MPP dihydrochloride Kaempferol Cholesterol G15 Endoxifen HCl Licochalcone A Chrysin Pregnenolone |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 598.08 | Formule | C32H36ClNO8 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 89778-27-8 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | NSC 613680,NK 622 Citrate | Smiles | CN(C)CCOC1=CC=C(C=C1)C(=C(CCCl)C2=CC=CC=C2)C3=CC=CC=C3.C(C(=O)O)C(CC(=O)O)(C(=O)O)O | ||
Solubilité
|
In vitro |
DMSO
: 100 mg/mL
(167.2 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
Estrogen receptor
|
|---|---|
| In vitro |
Le torémifène (7,5 mM) provoque chez environ 60 % des cellules des caractéristiques morphologiques typiques des cellules subissant une mort programmée, ou apoptose, dans les cellules humaines du cancer du sein. Le torémifène (5-10 mM) entraîne des niveaux élevés d'ARNm de TRPM-2 et de TGF bêta 1 dans les cellules tumorales cultivées in vitro ou in vivo. Le torémifène provoque une inhibition de la croissance des cellules de cancer du sein sensibles aux œstrogènes en induisant l'apoptose de certaines cellules et en empêchant d'autres cellules d'entrer en mitose. Le torémifène induit un niveau d'adduits dépendant de la dose qui est inférieur à celui observé pour le TAM. Le torémifène améliore significativement la formation d'adduits à l'ADN endogènes. Le torémifène affecte le renouvellement cellulaire en inhibant l'activité mitotique et en modifiant une abondante apoptose spontanée dans le carcinome mammaire de rat induit par le DMBA.
|
| In vivo |
Le torémifène, à la dose testée la plus élevée, augmente l'incidence des carcinomes hépatocellulaires dans les groupes initiés au DEN à un niveau un tiers de celui observé avec l'administration de Tamoxifène à des rats initiés au DEN. Le torémifène augmente l'incidence des hypernéphromes chez les rats précédemment initiés au DEN. Le torémifène entraîne une aneuploïdie chez 50 % des cellules examinées, contre un niveau de 85 % induit par le Tamoxifène chez les rates Sprague-Dawley.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT01214291 | Withdrawn | Risk of Bone Fracture Occurrences |
GTx|Ipsen |
March 2011 | Phase 3 |
| NCT00267553 | Terminated | Breast Neoplasms|Neoplasms Hormone-Dependent |
Intarcia Therapeutics |
November 2005 | Phase 3 |
| NCT00106691 | Completed | Preneoplastic Conditions|Prostatic Intraepithelial Neoplasia |
GTx |
January 2005 | Phase 3 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
