pour la recherche uniquement
NMS-873 p97 inhibiteur
Réf. CatalogueS7285
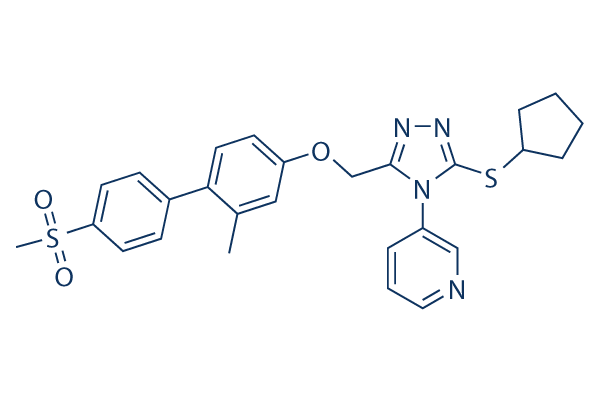
Structure chimique
Poids moléculaire: 520.67
Contrôle Qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- SDS
- Fiche technique
| Cibles apparentées | Proteasome E1 Activating E3 Ligase DUB SUMO E2 conjugating |
|---|---|
| Autre p97 Inhibiteurs | DBeQ CB-5339 ML240 NPD8733 |
Culture cellulaire, traitement et concentration de travail
| Lignées cellulaires | Type dessai | Concentration | Temps dincubation | Formulation | Description de lactivité | PMID |
|---|---|---|---|---|---|---|
| Hi5 cells | Function assay | 20 mins | Inhibition of human recombinant His-GST tagged VCP expressed in baculovirus infected Hi5 cells assessed as ADP formation incubated for 20 mins proir to substrate addition measured after 90 mins by NADH coupled assay, IC50=0.024 μM | |||
| HCT116 cells | Cytotoxic assay | 72 h | Cytotoxicity against human HCT116 cells after 72 hrs by luciferase reporter gene assay, IC50=0.38 μM | |||
| Cliquez pour voir plus de données expérimentales sur la lignée cellulaire | ||||||
Informations chimiques, stockage et stabilité
| Poids moléculaire | 520.67 | Formule | C27H28N4O3S2 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 1418013-75-8 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CC1=C(C=CC(=C1)OCC2=NN=C(N2C3=CN=CC=C3)SC4CCCC4)C5=CC=C(C=C5)S(=O)(=O)C | ||
Solubilité
|
In vitro |
DMSO
: 100 mg/mL
(192.06 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Caractéristiques |
The most potent and specific p97 inhibitor described to date.
|
|---|---|
| Targets/IC50/Ki |
p97
(Cell-free assay) 30 nM
|
| In vitro |
NMS-873 réduit la sensibilité de p97 à la digestion par la trypsine, empêchant la dégradation du domaine lieur-D2. Ce composé, en tant qu'inhibiteur de p97, produit une activité antiproliférative dans une variété de lignées tumorales hématologiques et solides. L'étude du mécanisme indique que cette substance chimique active la réponse des protéines dépliées, interfère avec l'autophagie et induit ainsi la mort des cellules cancéreuses.
|
| Essai kinase |
Développement d'essais biochimiques et HTS
|
|
L'activité ATPase et les paramètres cinétiques de la VCP de type sauvage recombinante et de ses mutants sont évalués en surveillant la formation d'ADP dans la réaction, à l'aide d'un essai couplé au NADH modifié. Étant donné que l'ADP et le NADH sont des inhibiteurs compétitifs de l'ATP de l'activité ATPase de la VCP, le protocole standard de l'essai couplé au NADH est modifié en une procédure en deux étapes. Dans la première partie, un système de régénération d'ATP (40 U/ml de pyruvate kinase et 3 mM de phosphoénolpyruvate) recycle l'ADP produit par l'activité de la VCP, maintient la concentration du substrat constante (empêchant ainsi l'inhibition du produit) et accumule une quantité stœchiométrique de pyruvate. Dans la deuxième partie, la réaction enzymatique de la VCP est arrêtée avec 30 mM d'EDTA et 250 μM de NADH et oxydée stœchiométriquement par 40 U/ml de lactate déshydrogénase pour réduire le pyruvate accumulé. La diminution de la concentration de NADH est mesurée à 340 nm à l'aide d'un lecteur de plaque Tecan Safire 2. L'essai est réalisé dans des plaques UV à 96 ou 384 puits dans un tampon de réaction contenant 50 mM d'Hepes, pH 7,5, 0,2 mg/mL de BSA, 10 mM de MgCl2 et 2 mM de DTT. Les données expérimentales sont ajustées avec une équation coopérative obtenant un Ks* d'environ 60 μM et un coefficient de Hill (n) de 2,0 ± 0,1. La campagne HTS est réalisée contre une bibliothèque de 1 million de composés à l'aide d'un essai miniaturisé au format 1 536 puits et d'un système de détection d'ADP plus sensible, Transcreener ADP FP. Une préincubation de 20 minutes de 10 nM de VCP et de 10 μM d'inhibiteur est effectuée, après quoi 10 μM d'ATP sont ajoutés à la réaction, qui est laissée à se dérouler pendant 90 minutes avant d'être arrêtée. Le Z' moyen du criblage est de 0,58, et le taux de succès utilisant 3× s.d. (38 % d'inhibition) comme seuil est de 1,7 %. Les hits primaires avec >60 % d'inhibition à une concentration de 10 μM sont élagués à l'aide de filtres physico-chimiques et structurels pour ne laisser que 7 516 composés. Au final, une reconfirmation est effectuée en double sur 3 988 hits primaires, et 500 composés sont sélectionnés pour une évaluation dose-réponse à l'aide de l'essai couplé modifié au NADH décrit précédemment. La puissance des hits HTS les plus intéressants est mesurée à la fois contre la VCP de type sauvage et le mutant C522T. Les concentrations d'ATP qui ont donné la vitesse semi-maximale (Ks*) pour chaque enzyme, correspondant à 60 μM et 130 μM pour le type sauvage et le mutant C522T, respectivement, sont utilisées dans l'essai. Pour explorer la dépendance des inhibiteurs réversibles de la concentration du substrat, leur puissance est également évaluée à une concentration d'ATP saturante (1 mM) et comparée à la puissance d'un inhibiteur compétitif standard de l'ATP (AMP-PNP).
|
Références |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
