pour la recherche uniquement
Tenofovir Disoproxil Fumarate Reverse Transcriptase inhibiteur
Réf. CatalogueS1400
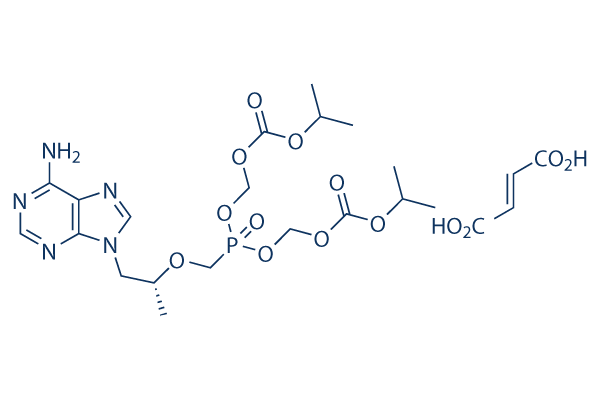
Structure chimique
Poids moléculaire: 635.51
Contrôle Qualité
| Cibles apparentées | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Parasite HIV HCV Protease |
|---|---|
| Autre Reverse Transcriptase Inhibiteurs | Dapivirine (TMC120) Fangchinoline Salicylanilide 3'-Fluoro-3'-deoxythymidine (Alovudine) Ulonivirine Lersivirine (UK-453061) Bifendate 4-Chloro-2-(trifluoroacetyl)aniline hydrochloride |
Culture cellulaire, traitement et concentration de travail
| Lignées cellulaires | Type dessai | Concentration | Temps dincubation | Formulation | Description de lactivité | PMID |
|---|---|---|---|---|---|---|
| MT2 | Function assay | 5 days | Inhibition of virus-induced cytopathic effect in wild type HIV 3a infected MT2 cells after 5 days, EC50=0.015μM | 17562366 | ||
| HepG2 | Cytotoxicity assay | 9 days | Cytotoxicity against human HepG2 cells after 9 days by MTT assay, IC50=2.31μM | 17888662 | ||
| HepG2 | Antiviral assay | 9 days | Antiviral activity against Hepatitis B virus infected human HepG2 cells after 9 days by MTT assay, IC50=5.1μM | 17888662 | ||
| MT-2 | Antiviral assay | Antiviral activity against HIV1 3B infected in human MT-2 cells by two fold dilution method in presence of 10% FBS, EC50=0.0068μM | 19104010 | |||
| MT2 | Antiviral assay | Antiviral activity against HIV1 infected in human MT2 cells assessed as inhibition of viral replication, IC50=0.54μM | 19596885 | |||
| HeLa P4/R5 | Antiviral assay | Antiviral activity against HIV1 infected in human HeLa P4/R5 cells assessed as inhibition of viral replication, IC50=4.7μM | 19596885 | |||
| HeLa P4/R5 | Antiviral assay | Antiviral activity against HIV1 harboring reverse transcriptase K65R mutant infected in human HeLa P4/R5 cells assessed as inhibition of viral replication, IC50=11.4μM | 19596885 | |||
| human bone marrow cells | Cytotoxicity assay | 24 hrs | Cytotoxicity against human bone marrow cells after 24 hrs by BFU-E assay, CC50=0.9μM | 20439609 | ||
| human bone marrow cells | Cytotoxicity assay | 24 hrs | Cytotoxicity against human bone marrow cells after 24 hrs by GM-CFU assay, CC50=1.9μM | 20439609 | ||
| HeLa-T4 | Antiviral assay | 48 hrs | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef infected in human HeLa-T4 cells assessed as luciferase activity after 48 hrs by exogenous RT assay, EC50=0.0029μM | 21060108 | ||
| HeLa-T4 | Antiviral assay | 48 hrs | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef infected in human HeLa-T4 cells assessed as luciferase activity after 48 hrs by exogenous RT assay, EC95=0.037μM | 21060108 | ||
| HeLaT4 | Antiviral assay | 24 hrs | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef assessed as level of infection using human HeLaT4 cells pretreated for 24 hrs followed by exposed to vi, EC50=0.12μM | 21060108 | ||
| HeLaT4 | Antiviral assay | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef assessed as level of 2 mins magnetic nanopartials-medated infection in human HeLaT4 cells treated for 1, EC99.6=0.95μM | 21060108 | |||
| HeLaT4 | Cytotoxicity assay | Cytotoxicity against human HeLaT4 cells by WST-1 assay, CC50=34μM | 21060108 | |||
| HeLaT4 | Function assay | 24 hrs | Drug uptake in human HeLaT4 cells assessed as compound persist measured after 3 times washout at 100 time EC95 for HIV1 for 24 hrs | 21060108 | ||
| HeLaT4 | Antiviral assay | 24 hrs | Antiviral activity against single-round HIV1 NLX.Lux-R harboring inactivating mutations in env, vpr and carries firefly luciferase gene in place of nef assessed as level of infection using human HeLaT4 cells pretreated at 100 time EC95 for 24 hrs followed | 21060108 | ||
| PBMC | Antiviral assay | 7 days | Antiviral activity against HIV1 infected in human PBMC assessed as inhibition of viral replication by measuring reverse transcriptase activity in cell supernatant preincubated with cells followed by viral infection measured after 7 days by radioactive inc, EC50=0.0046μM | 27405794 | ||
| HepG2.2.15 | Antiviral assay | 3 days | Antiviral activity against HBV infected in human HepG2.2.15 cells assessed as inhibition of viral DNA in cell supernatant incubated for 3 days in presence of 10% FBS followed by compound treatment in absence of 10% FBS for 3 days by qRT-PCR method, EC50=0.34μM | 27405794 | ||
| HepG2.2.15 | Cytotoxicity assay | 6 days | Cytotoxicity against human HepG2.2.15 cells assessed as reduction in cell viability after 6 days by XTT assay, CC50=29.2μM | 27405794 | ||
| PBMC | Antiviral assay | 30 mins | Antiviral activity against CXCR4-tropic HIV-1 NL4-3 infected in human PHA-stimulated PBMC assessed as inhibition of viral replication by measuring reduction in p24 antigen production preincubated with cells for 30 mins followed by viral infection measured, IC50=0.08μM | 28682067 | ||
| PBMC | Antiviral assay | 30 mins | Antiviral activity against CCR5 tropic HIV1 BaL infected in human PHA-stimulated PBMC assessed as inhibition of viral replication by measuring reduction in p24 antigen production preincubated with cells for 30 mins followed by viral infection measured on , IC50=0.22μM | 28682067 | ||
| MT4 | Antiviral assay | 6 days | Antiviral activity against CXCR4-tropic HIV-1 NL4-3 infected in human MT4 cells assessed as inhibition of virus-induced cytopathic effect after 6 days by XTT dye based assay, EC50=4.89μM | 28682067 | ||
| MT4 | Antiviral assay | 6 days | Antiviral activity against tenofovir-resistant CXCR4-tropic HIV-1 NL4-3 harboring reverse transcriptase K65R mutant infected in human MT4 cells assessed as inhibition of viral replication inhibition of virus-induced cytopathic effect after 6 days by XTT d, EC50=11.3μM | 28682067 | ||
| HepG2.2.15 | Antiviral assay | Antiviral activity against HBV infected in human HepG2.2.15 cells assessed as reduction in cytoplasmic DNA synthesis by reed and munch method, IC50=0.85μM | 31223460 | |||
| HepG2.2.15 | Cytotoxicity assay | Cytotoxicity against human HepG2.2.15 cells infected with HBV, CC50=20.71μM | 31223460 | |||
| Cliquez pour voir plus de données expérimentales sur la lignée cellulaire | ||||||
Informations chimiques, stockage et stabilité
| Poids moléculaire | 635.51 | Formule | C19H30N5O10P.C4H4O4 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 202138-50-9 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | GS 1278, Tenofovir DF | Smiles | CC(C)OC(=O)OCOP(=O)(COC(C)CN1C=NC2=C(N=CN=C21)N)OCOC(=O)OC(C)C.C(=CC(=O)O)C(=O)O | ||
Solubilité
|
In vitro |
DMSO
: 100 mg/mL
(157.35 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
HIV reverse transcriptase
(Cell-free assay) |
|---|---|
| In vitro |
Le ténofovir est éliminé de la circulation systémique par voie rénale via une combinaison de filtration glomérulaire et de sécrétion tubulaire active. Le ténofovir n'est pas un substrat pour le transporteur de cations organiques humains de type 1 (hOCT1) ou hOCT2. Le ténofovir s'accumule à des niveaux cinq fois inférieurs dans les cellules surexprimant MRP4, et son accumulation pourrait être augmentée par un inhibiteur de MRP. Le ténofovir ne produit aucun changement significatif des niveaux d'ADN mitochondrial (ADNmt) dans les cellules d'hépatoblastome humain (HepG2), les cellules musculaires squelettiques (SkMCs) ou les cellules épithéliales des tubules proximaux rénaux. Le ténofovir augmente la production de lactate de moins de 20 % dans les cellules HepG2 ou les SkMCs. Le ténofovir est efficacement phosphorylé en ténofovir diphosphate (TFV-DP) dans les cellules HepG2 et les hépatocytes humains primaires. Le ténofovir a une concentration efficace de 50 % de 1,1 mM contre le VHB dans les essais basés sur des cellules, et la puissance est améliorée de > 50 fois par l'ajout de progroupe bis-isoproxil. Le ténofovir a précédemment démontré une activité complète contre le VHB résistant à la lamivudine in vitro et cliniquement. Le ténofovir inhibe la prolifération des cellules HepG2 dérivées du foie et des cellules musculaires squelettiques normales avec des valeurs de CC(50) de 398 μM et 870 μM, respectivement. Le ténofovir montre des effets substantiellement plus faibles sur la prolifération et la viabilité des cellules épithéliales des tubules proximaux rénaux que le cidofovir, un analogue nucléotidique apparenté ayant le potentiel d'induire une dysfonction tubulaire rénale. |
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT05874440 | Recruiting | Chronic Hepatitis b Patients |
Sohag University |
April 15 2023 | -- |
| NCT03576066 | Completed | Chronic Hepatitis B |
Assembly Biosciences |
June 11 2018 | Phase 2 |
| NCT03361956 | Completed | Hepatitis B |
Janssen Sciences Ireland UC |
February 13 2018 | Phase 2 |
| NCT02985996 | Completed | HIV Infections |
Emory University|Centers for Disease Control and Prevention |
February 6 2017 | Phase 1 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
