pour la recherche uniquement
OC000459 GPR antagoniste
Réf. CatalogueS2822
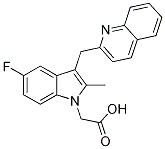
Structure chimique
Poids moléculaire: 348.37
Contrôle Qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- SDS
- Fiche technique
Informations chimiques, stockage et stabilité
| Poids moléculaire | 348.37 | Formule | C21H17FN2O2 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 851723-84-7 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CC1=C(C2=C(N1CC(=O)O)C=CC(=C2)F)CC3=NC4=CC=CC=C4C=C3 | ||
Solubilité
|
In vitro |
DMSO
: 4 mg/mL
(11.48 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
DP2
13 nM
|
|---|---|
| In vitro |
OC000459 inhibe la liaison de [3H]PGD2 aux membranes de cellules CHO transfectées avec le DP2 humain avec un Ki de 13 nM. Ce composé déplace également le [3H]PGD2 des membranes de lymphocytes Th2 humains avec un Ki de 4 nM. Il antagonise la mobilisation du calcium médiée par PGD2 de manière concentration-dépendante avec une IC50 de 28 nM dans les cellules CHO intactes exprimant le DP2. Ce produit chimique inhibe la chimiotaxie des cellules Th2 humaines en réponse au PGD2 (10 nM) avec une IC50 de 28 nM. Il antagonise l'effet du PGD2 de manière compétitive à la fois dans la préparation de leucocytes isolés et dans le sang total humain hépariné. Ce composé inhibe les réponses de changement de forme des éosinophiles au DK-PGD2 avec une IC50 de 11 nM. Il inhibe l'activation des cellules Th2 et des éosinophiles en réponse aux surnageants de mastocytes.
|
| In vivo |
OC000459 administré à des doses de 2 mg/kg p.o. chez les rats Sprague-Dawley montre une demi-vie plasmatique de 2,9 heures, un temps pour atteindre la concentration plasmatique maximale de 1,3 heure, une concentration plasmatique maximale atteinte de 1,54 μg/mL. Ce composé administré par voie orale 0,5 heure avant l'injection de DK-PGD2 conduit à une réduction dose-dépendante de l'éosinophilie sanguine avec une ED50 de 0,04 mg/kg chez les rats. Administré par voie orale 0,5 heure avant l'injection de DK-PGD2, il entraîne également une inhibition dose-dépendante de l'accumulation d'éosinophiles avec une ED50 de 0,01 mg/kg chez les rats. Ce produit chimique (200 mg deux fois par jour pendant 28 jours) administré à des patients atteints d'asthme persistant modéré montre une amélioration de la qualité de vie, analysée pour la population en analyse complète (FA) et la population per protocole (PP). Chez ces patients, il améliore les scores de symptômes nocturnes, réduit le nombre géométrique moyen d'éosinophiles dans les expectorations et les infections respiratoires. Ce composé (200 mg deux fois par jour) inhibe les réponses asthmatiques tardives et l'augmentation post-allergène des éosinophiles dans les expectorations chez les patients asthmatiques naïfs de stéroïdes.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT02560610 | Completed | Severe Eosinophilic Asthma |
Chiesi Farmaceutici S.p.A.|Atopix Therapeutics Ltd. |
September 2016 | Phase 2 |
| NCT01056783 | Completed | Eosinophilic Esophagitis |
Oxagen Ltd |
August 2010 | Phase 2 |
| NCT01056575 | Completed | Healthy Volunteers |
Oxagen Ltd |
February 2010 | Phase 1 |
| NCT01448902 | Completed | Allergic Rhinitis |
Oxagen Ltd |
March 2007 | Phase 2 |
| NCT00290381 | Completed | Allergic Rhinitis |
Trevor Hansel|Oxagen Ltd|Imperial College London |
Phase 1|Phase 2 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
