pour la recherche uniquement
Mepivacaine HCl Sodium Channel inhibiteur
Réf. CatalogueS3155
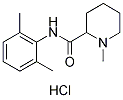
Structure chimique
Poids moléculaire: 282.81
Contrôle Qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- HPLC
- SDS
- Fiche technique
| Cibles apparentées | CFTR CRM1 CD markers AChR Calcium Channel Potassium Channel GABA Receptor TRP Channel ATPase GluR |
|---|---|
| Autre Sodium Channel Inhibiteurs | Camostat Mesilate A-803467 cariporide Tolperisone HCl Vinpocetine Veratramine Bulleyaconi cine A Ambroxol HCl Benzocaine Nefopam HCl |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 282.81 | Formule | C15H22N2O.HCl |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 1722-62-9 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CC1=C(C(=CC=C1)C)NC(=O)C2CCCCN2C.Cl | ||
Solubilité
|
In vitro |
Water : 57 mg/mL Ethanol : 8 mg/mL
DMSO
: 3 mg/mL
(10.6 mM)
|
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| In vivo |
Les tests effectués chez le cheval montrent une plus grande diffusion de la Mepivacaine entre les structures synoviales adjacentes que ce qui était supposé d'après les études anatomiques, d'injection de latex et d'arthrographie de contraste précédentes. L'échographie permet une réduction de 37 % du volume anesthésique efficace minimal (MEAV50) de Mepivacaine à 1,5 % nécessaire pour bloquer le nerf sciatique, par rapport à la neurostimulation chez les patients subissant une arthroscopie du genou. L'utilisation de Mepivacaine à 3 % procure une durée d'anesthésie plus courte que les formulations de lidocaïne avec de l'épinéphrine chez les canines et les prémolaires.
|
Références |
|
|---|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT04257682 | Not yet recruiting | Knee Osteoarthritis|Hip Osteoarthritis |
Ottawa Hospital Research Institute |
September 2022 | Phase 4 |
| NCT01533545 | Terminated | Renal Insufficiency Chronic |
Rigshospitalet Denmark |
September 2012 | Not Applicable |
| NCT01032798 | Completed | Local Anesthetic Effectiveness |
University of Campinas Brazil|Fundação de Amparo à Pesquisa do Estado de São Paulo |
May 2007 | Phase 1 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
