pour la recherche uniquement
Bupivacaine HCl Sodium Channel inhibiteur
Réf. CatalogueS2454
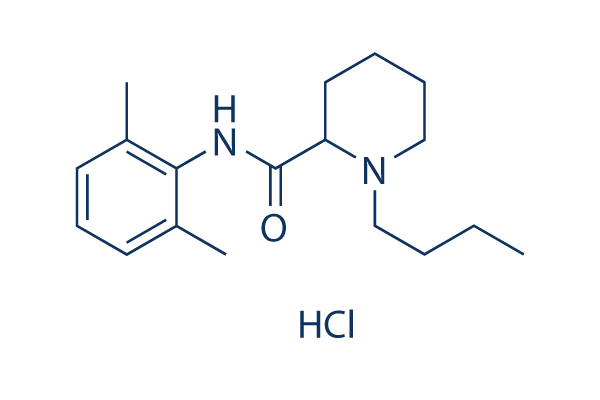
Structure chimique
Poids moléculaire: 324.89
Contrôle Qualité
| Cibles apparentées | CFTR CRM1 CD markers AChR Calcium Channel Potassium Channel GABA Receptor TRP Channel ATPase GluR |
|---|---|
| Autre Sodium Channel Inhibiteurs | Camostat Mesilate A-803467 cariporide Tolperisone HCl Vinpocetine Veratramine Bulleyaconi cine A Ambroxol HCl Benzocaine Nefopam HCl |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 324.89 | Formule | C18H28N2O.HCl |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 18010-40-7 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CCCCN1CCCCC1C(=O)NC2=C(C=CC=C2C)C.Cl | ||
Solubilité
|
In vitro |
DMSO
: 65 mg/mL
(200.06 mM)
Water : 65 mg/mL Ethanol : 65 mg/mL |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
Sodium channel
|
|---|---|
| In vitro |
La solution de Bupivacaine est cytotoxique pour les chondrocytes articulaires bovins et le cartilage articulaire in vitro après seulement 15 à 30 minutes d'exposition. La Bupivacaine agit dans les mitochondries isolées, comme désaccoupleur entre la consommation d'oxygène et la phosphorylation de l'adénosine diphosphate. La Bupivacaine provoque une dépolarisation mitochondriale et une oxydation des nucléotides pyridiniques dépendantes de la concentration dans les mitochondries isolées, qui sont associées à une augmentation de la consommation d'oxygène à des concentrations de Bupivacaine de 1,5 mm ou moins à pH 7,4, tandis que la respiration est inhibée à des concentrations plus élevées. La Bupivacaine provoque l'ouverture du pore de transition de perméabilité (PTP), un canal de la membrane interne sensible à la cyclosporine A qui joue un rôle clé dans de nombreuses formes de mort cellulaire. La Bupivacaine provoque une dépolarisation mitochondriale et une oxydation des nucléotides pyridiniques qui sont associées à des concentrations accrues de Ca(2+) libre cytosolique, à la libération du cytochrome c, et finalement, à une hypercontracture dans les fibres intactes du court fléchisseur des doigts. La Bupivacaine inhibe les canaux GIRK quelques secondes après l'application, que les canaux soient activés par le récepteur muscarinique ou directement via les sous-unités G(bêta)gamma de la protéine G co-exprimées. La Bupivacaine inhibe également les courants GIRK induits par l'alcool en l'absence de protéines G fonctionnelles sensibles à la toxine de la coqueluche. Bupivacaine HCl inhibe également potentiellement la production d'AMPc avec une IC50 de 2,3 μM.
|
| In vivo |
La Bupivacaine n'induit pas seulement la libération de Ca2+ du réticulum sarcoplasmique (RS) chez les rats, mais inhibe également l'absorption de Ca2+ par le RS, qui est principalement régulée par l'activité de l'adénosine triphosphatase Ca2+ du RS.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT05038956 | Not yet recruiting | Video-assisted Thoracic Surgery (VATS) |
University of Utah |
May 1 2024 | -- |
| NCT06252662 | Not yet recruiting | Breast Cancer |
United States Naval Medical Center Portsmouth |
April 2024 | Phase 4 |
| NCT06350981 | Not yet recruiting | Back Pain|Surgery-Complications|Narcotic Use|Physical Stress|Post Operative Pain |
Foundation for Orthopaedic Research and Education|Pacira Pharmaceuticals Inc |
April 1 2024 | Phase 2|Phase 3 |
| NCT04003506 | Not yet recruiting | Pain Postoperative |
The University of Hong Kong |
March 1 2024 | Phase 4 |
| NCT06293404 | Not yet recruiting | Hip Fractures|Spinal Anesthesia |
Ankara City Hospital Bilkent |
March 1 2024 | Not Applicable |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
