pour la recherche uniquement
KW-2449 FLT3 inhibiteur
Réf. CatalogueS2158
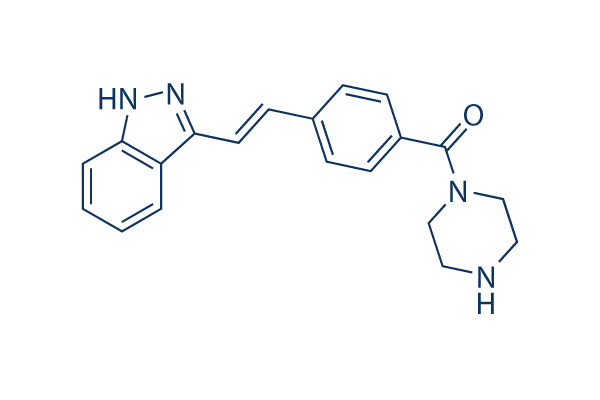
Structure chimique
Poids moléculaire: 332.4
Contrôle Qualité
| Cibles apparentées | EGFR VEGFR JAK PDGFR FGFR Src HIF FLT HER2 Bcr-Abl |
|---|---|
| Autre FLT3 Inhibiteurs | UNC2025 Crenolanib (CP-868596) Dovitinib (TKI-258) Dovitinib (TKI258) Lactate monohydrate Tandutinib (MLN518) ENMD-2076 AST-487 (NVP-AST487) TCS 359 G-749 AMG 925 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 332.4 | Formule | C20H20N4O |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 1000669-72-6 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | C1CN(CCN1)C(=O)C2=CC=C(C=C2)C=CC3=NNC4=CC=CC=C43 | ||
Solubilité
|
In vitro |
DMSO
: 67 mg/mL
(201.56 mM)
Ethanol : 67 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Caractéristiques |
Investigated as a FLT3 inhibitor in clinical trials, with others in early development.
|
|---|---|
| Targets/IC50/Ki |
FLT3 (D835Y)
(Cell-free assay) 1 nM
Abl (T315I)
(Cell-free assay) 4 nM
FLT3
(Cell-free assay) 6.6 nM
Abl
(Cell-free assay) 14 nM
FGFR1
(Cell-free assay) 36 nM
Aurora A
(Cell-free assay) 48 nM
JAK2
(Cell-free assay) 150 nM
Kit
(Cell-free assay) 300 nM
Src
(Cell-free assay) 400 nM
|
| In vitro |
KW-2449, un inhibiteur multikinase de FLT3, ABL, ABL-T315I et Aurora kinase, est en cours d'investigation pour traiter les patients atteints de leucémie. Ce composé montre des effets inhibiteurs de croissance puissants sur les cellules leucémiques avec des mutations FLT3 par inhibition de la FLT3 kinase, entraînant une régulation à la baisse de FLT3/STAT5 phosphorylé, un arrêt en G1 et une apoptose. L'administration orale de cette substance chimique montre une inhibition de la croissance tumorale dose-dépendante et significative dans un modèle de xénogreffe muté FLT3 avec une suppression minimale de la moelle osseuse. Dans la leucémie humaine de type sauvage FLT3, il induit la réduction de l'histone H3 phosphorylée, l'arrêt en G2/M et l'apoptose. Dans la leucémie résistante à l'imatinib, cet agent contribue à la libération de la résistance par la régulation à la baisse simultanée des kinases BCR/ABL et Aurora. L'activité inhibitrice de ce composé n'est pas affectée par la présence de protéines plasmatiques humaines, telles que l'α1-glycoprotéine acide. Il possède de puissantes activités inhibitrices de croissance contre divers types de leucémie par plusieurs mécanismes d'action. Cet inhibiteur a une activité significative et justifie une étude clinique chez les patients atteints de leucémie présentant des mutations FLT3 ainsi que des mutations résistantes à l'imatinib. Les niveaux de phosphorylation de FLT3 et STAT5 sont diminués par cette substance chimique de manière dose-dépendante. De plus, il inhibe puissamment ABL-T315I, qui est associé à la résistance à l'IM, avec un IC50 de 4 nM. D'autre part, ce composé a peu d'effet sur PDGFRβ, IGF-1R, EGFR et diverses sérine/thréonine kinases même à une concentration de 1 μM. Il a de puissantes activités inhibitrices de croissance contre non seulement les cellules leucémiques exprimant FLT3/ITD, mais aussi les cellules leucémiques activées par FLT3/KDM et celles surexprimant FLT3 de type sauvage. Conformément à l'effet inhibiteur de croissance, cet agent supprime les phosphorylations de FLT3 (P-FLT3) et de sa molécule en aval phospho-STAT5 (P-STAT5) dans les cellules MOLM-13 de manière dose-dépendante. En outre, il augmente le pourcentage de cellules en phase G1 du cycle cellulaire et réduit réciproquement le pourcentage de cellules en phase S, ce qui entraîne une augmentation de la population de cellules apoptotiques. Ce composé peut déphosphoryler la kinase WT-FLT3 constitutivement active, mais n'inhibe pas la prolifération des cellules leucémiques si elles ne sont pas principalement dépendantes de la kinase FLT3. Il est rapidement absorbé et converti en un métabolite majeur M1. Des études précliniques révèlent que cette substance chimique est convertie par la monoamine oxydase-B (MAO-B) et l'aldéhyde oxydase en son métabolite majeur M1. Cet agent médiatise la cytotoxicité par l'inhibition de FLT3/ITD. C'est un inhibiteur direct de FLT3 et il induit l'inhibition de sa cible en aval STAT5. Ce composé interagit de manière synergique avec les HDACIs pour induire l'apoptose dans les cellules CML Ph+ de manière dépendante du temps et de la concentration. Il améliore synergiquement la létalité du vorinostat/SNDX275 dans les cellules CML. Ces régimes d'inhibiteurs sont actifs contre des cellules leucémiques Bcr/Abl+ résistantes à l'IM supplémentaires. Il réduit modérément la phosphorylation de l'histone H3, un indicateur de l'activité d'Aurora B, dans les cellules K562 traitées au nocodazole.
|
| Essai kinase |
Phosphorylation de FLT3
|
|
Les cellules leucémiques sont lavées dans une solution saline tamponnée au phosphate (PBS), puis lysées par remise en suspension des cellules dans un tampon de lyse (20 mM Tris pH 7,4, 100 mM NaCl, 1 % Igepal, 1 mM EDTA, 2 mM NaVO4, plus un inhibiteur de protéase complet KW-2449 pendant 30 minutes sous agitation. L'extrait est clarifié par centrifugation à 1,6 × 104 g et le surnageant est analysé pour les protéines (Bio-Rad). Une aliquote de 50 μg est prélevée comme lysat de cellules entières pour l'analyse de STAT5, et le reste est utilisé pour l'immunoprécipitation avec anti-FLT3. L'anticorps anti-FLT3 est ajouté à l'extrait pour une incubation d'une nuit, puis la protéine A-sépharose est ajoutée pendant 2 heures supplémentaires. Des gels d'électrophorèse sur gel de polyacrylamide au dodécylsulfate de sodium (SDS-PAGE) séparés pour le lysat de cellules entières et les immunoprécipités sont exécutés en parallèle. Après transfert sur des membranes Immobilon, un immunoblotting est effectué avec un anticorps anti-phosphotyrosine (4G10) pour détecter FLT3 phosphorylé ou, pour les gels de lysat de cellules entières, avec un anticorps monoclonal de rat contre STAT5 phosphorylé (résidu Y694) puis décapé et reprobé avec un anticorps anti-FLT3 pour mesurer le FLT3 total. Les protéines sont visualisées par chimiluminescence, exposées sur un film Kodak BioMax XAR, développées et scannées à l'aide d'un densitomètre Bio-Rad GS800. La concentration de ce composé pour laquelle la phosphorylation de FLT3 ou STAT5 est inhibée à 50 % de sa ligne de base (IC50) est déterminée par analyse de régression linéaire des courbes dose-réponse. Pour l'analyse directe de FLT3 et STAT5 dans les blastes circulants, le sang périphérique est recueilli dans des tubes héparinés et rapidement refroidi sur de la glace. Les échantillons sont centrifugés pendant 10 minutes à 900 g, à 4 °C. Le plasma est retiré et stocké congelé à –80 °C. La couche leucocytaire est soigneusement transférée dans du PBS glacé, superposée sur du Ficoll-Hypaque refroidi, et centrifugée pendant 5 minutes à 600 g, à 4 °C. Toutes les étapes ultérieures sont réalisées à 4 °C. Les cellules mononucléaires sont collectées et lavées rapidement une fois dans un tampon de lyse des globules rouges (0,155 M NH4Cl, 0,01 M KHCO3, 0,1 mM EDTA), puis lavées une fois dans du PBS. Les cellules sont ensuite lysées comme décrit pour l'analyse de FLT3 et STAT5.
|
|
| In vivo |
Dans le modèle de xénogreffe tumorale MOLM-13, l'administration orale de KW-2449 pendant 14 jours montre un effet antitumoral puissant et significatif de manière dose-dépendante.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT00346632 | Terminated | Acute Myelogenous Leukemia|Acute Lymphoblastic Leukemia|Myelodysplastic Syndromes|Chronic Myelogenous Leukemia |
Kyowa Kirin Inc. |
June 2006 | Phase 1 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
