pour la recherche uniquement
Dovitinib (TKI258) Lactate monohydrate FLT3 inhibiteur
Réf. CatalogueS7765
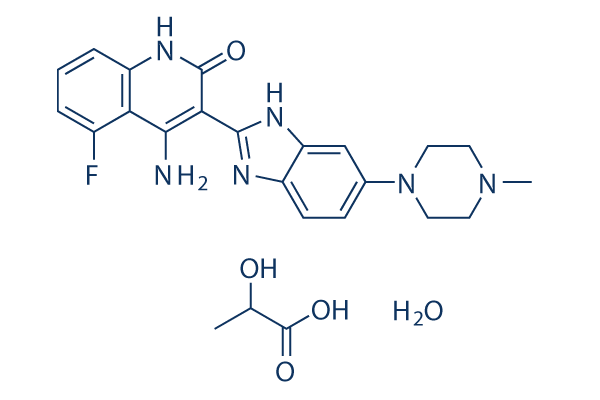
Structure chimique
Poids moléculaire: 500.52
Contrôle Qualité
| Cibles apparentées | EGFR VEGFR JAK PDGFR FGFR Src HIF FLT HER2 Bcr-Abl |
|---|---|
| Autre FLT3 Inhibiteurs | UNC2025 Crenolanib (CP-868596) Dovitinib (TKI-258) Tandutinib (MLN518) KW-2449 ENMD-2076 AST-487 (NVP-AST487) TCS 359 G-749 AMG 925 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 500.52 | Formule | C24H29FN6O5 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 915769-50-5 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | CHIR258 | Smiles | CC(C(=O)O)O.CN1CCN(CC1)C2=CC3=C(C=C2)N=C(N3)C4=C(C5=C(C=CC=C5F)NC4=O)N.O | ||
Solubilité
|
In vitro |
DMSO
: 100 mg/mL
(199.79 mM)
Water : 66 mg/mL Ethanol : 1 mg/mL |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
FLT3
1 nM
c-Kit
2 nM
FGFR1
8 nM
VEGFR3/FLT4
8 nM
FGFR3
9 nM
VEGFR1/FLT1
10 nM
VEGFR2/Flk1
13 nM
PDGFRβ
27 nM
CSF-1R/c-Fms
36 nM
|
|---|---|
| In vitro |
Le Dovitinib inhibe puissamment la croissance stimulée par le FGF des cellules B9 exprimant WT et F384L-FGFR3 avec un IC50 de 25 nM. De plus, le Dovitinib inhibe la prolifération des cellules B9 exprimant chacune des diverses mutations activées de FGFR3. Il est intéressant de noter qu'il y a des différences minimes observées dans la sensibilité des différentes mutations de FGFR3 au Dovitinib, l'IC50 allant de 70 à 90 nM pour chacune des diverses mutations. Les cellules B9 dépendantes de l'IL-6 contenant uniquement le vecteur (cellules B9-MINV) sont résistantes à l'activité inhibitrice du Dovitinib à des concentrations allant jusqu'à 1 μM. Le Dovitinib inhibe la prolifération cellulaire des cellules KMS11 (FGFR3-Y373C), OPM2 (FGFR3-K650E) et KMS18 (FGFR3-G384D) avec un IC50 de 90 nM (KMS11 et OPM2) et 550 nM, respectivement. Le Dovitinib inhibe la phosphorylation d'ERK1/2 médiée par le FGF et induit une cytotoxicité dans les cellules MM primaires exprimant FGFR3. Les BMSC confèrent un degré modeste de résistance avec une inhibition de la croissance de 44,6 % pour les cellules traitées avec 500 nM de Dovitinib et cultivées sur stroma, comparativement à 71,6 % d'inhibition de la croissance pour les cellules cultivées sans BMSC. Le Dovitinib inhibe la prolifération de M-NFS-60, une lignée cellulaire myéloblastique murine à croissance dépendante du M-CSF, avec une concentration efficace médiane (EC50) de 220 nM. Le traitement des cellules SK-HEP1 avec le Dovitinib entraîne une réduction dose-dépendante du nombre de cellules et un arrêt en phase G2/M avec une réduction des phases G0/G1 et S, une inhibition de la croissance indépendante de l'ancrage et un blocage de la motilité cellulaire induite par le bFGF. L'IC50 du Dovitinib dans les cellules SK-HEP1 est d'environ 1,7 μM. Le Dovitinib réduit également significativement les niveaux de phosphorylation basale de FGFR-1, du substrat 2α de FGFR (FRS2-α) et d'ERK1/2, mais pas d'Akt, dans les cellules SK-HEP1 et 21-0208. Dans les cellules HCC 21-0208, le Dovitinib inhibe significativement la phosphorylation induite par le bFGF de FGFR-1, FRS2-α, ERK1/2, mais pas d'Akt. |
| Essai kinase |
Essais de kinase in vitro
|
|
Les valeurs de concentration inhibitrice de 50 % (IC50) pour l'inhibition des RTK par le Dovitinib sont déterminées dans un format de fluorescence résolue dans le temps (TRF) ou radioactif, mesurant l'inhibition par le Dovitinib du transfert de phosphate à un substrat par l'enzyme respective. Les domaines kinase de FGFR3, FGFR1, PDGFRβ et VEGFR1-3 sont testés dans 50 mM HEPES (acide N-2-hydroxyéthylpipérazine-N'-2-éthanesulfonique), pH 7,0, 2 mM MgCl2, 10 mM MnCl2, 1 mM NaF, 1 mM dithiothréitol (DTT), 1 mg/mL d'albumine sérique bovine (BSA), 0,25 μM de substrat peptidique biotinylé (GGGGQDGKDYIVLPI) et 1 à 30 μM d'adénosine triphosphate (ATP) en fonction du Km de l'enzyme respective. Les concentrations d'ATP sont égales ou juste inférieures au Km. Pour les réactions de c-KIT et FLT3, le pH est augmenté à 7,5 avec 0,2 à 8 μM d'ATP en présence de 0,25 à 1 μM de substrat peptidique biotinylé (GGLFDDPSYVNVQNL). Les réactions sont incubées à température ambiante pendant 1 à 4 heures et le peptide phosphorylé est capturé sur des microplaques revêtues de streptavidine contenant un tampon d'arrêt de réaction (25 mM EDTA [acide éthylènediaminetétraacétique], 50 mM HEPES, pH 7,5). Le peptide phosphorylé est mesuré avec le système DELFIA TRF en utilisant un anticorps anti-phosphotyrosine PT66 marqué à l'Europium. La concentration de Dovitinib pour l'IC50 est calculée par régression non linéaire avec le logiciel d'analyse de données XL-Fit version 4.1 (IDBS). L'inhibition de l'activité kinase du récepteur du facteur stimulant les colonies-1 (CSF-1R), de PDGFRα, du récepteur de l'insuline (InsR) et du récepteur du facteur de croissance de type insulinique 1 (IGFR1) est déterminée à des concentrations d'ATP proches du Km de l'ATP.
|
|
| In vivo |
Le Dovitinib induit des réponses à la fois cytostatiques et cytotoxiques in vivo, entraînant la régression des tumeurs exprimant FGFR3. Le Dovitinib montre une inhibition dose- et exposition-dépendante des récepteurs tyrosine kinases (RTK) cibles exprimés dans les xénogreffes tumorales. Le Dovitinib inhibe puissamment la croissance tumorale de six lignées de CHC. L'inhibition de l'Angiogenesis est corrélée à l'inactivation des voies de signalisation FGFR/PDGFRβ/VEGFR2. Dans un modèle orthotopique, le Dovitinib inhibe puissamment la croissance tumorale primaire et les métastases pulmonaires et prolonge significativement la survie des souris. L'administration de Dovitinib entraîne une inhibition significative de la croissance tumorale et des régressions tumorales, y compris des tumeurs volumineuses et établies (500-1 000 mm3). |
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT05571969 | Recruiting | Advanced Solid Tumors |
Allarity Therapeutics|Amarex Clinical Research |
February 20 2023 | Phase 1 |
| NCT02268435 | Withdrawn | Gastrointestinal Stromal Tumors |
Asan Medical Center |
March 2015 | Phase 1 |
| NCT01700270 | Completed | Advanced Solid Tumors Excluding Breast Cancer |
Novartis Pharmaceuticals|Novartis |
May 2013 | Phase 1 |
| NCT01680796 | Withdrawn | Multiple Myeloma |
University of Florida|Novartis Pharmaceuticals |
February 2013 | Phase 1 |
| NCT01266070 | Terminated | Von Hippel-Lindau Syndrome |
M.D. Anderson Cancer Center|Novartis |
November 2012 | Phase 2 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
