pour la recherche uniquement
LY2811376 BACE inhibiteur
Réf. CatalogueS1528
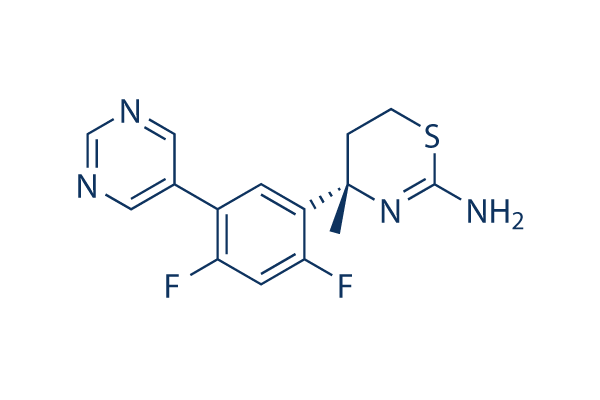
Structure chimique
Poids moléculaire: 320.36
Contrôle Qualité
| Cibles apparentées | HDAC Caspase Proteasome Secretase MMP HCV Protease Cysteine Protease DPP Tyrosinase HIV Protease |
|---|---|
| Autre BACE Inhibiteurs | Verubecestat (MK-8931) LY2886721 Verubecestat (MK-8931) Trifluoroacetate AZD3839 Lanabecestat (AZD3293) Elenbecestat Loganin LX2343 |
Culture cellulaire, traitement et concentration de travail
| Lignées cellulaires | Type dessai | Concentration | Temps dincubation | Formulation | Description de lactivité | PMID |
|---|---|---|---|---|---|---|
| HEK293 cells | Function assay | Inhibition of BACE1 in HEK293 cells expressing APPswedish mutant assessed as inhibition of amyloid beta production by ELISA, EC50=0.3 μM | ||||
| Cliquez pour voir plus de données expérimentales sur la lignée cellulaire | ||||||
Informations chimiques, stockage et stabilité
| Poids moléculaire | 320.36 | Formule | C15H14F2N4S |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 1194044-20-6 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CC1(CCSC(=N1)N)C2=C(C=C(C(=C2)C3=CN=CN=C3)F)F | ||
Solubilité
|
In vitro |
Ethanol : 64 mg/mL
DMSO
: 16 mg/mL
(49.94 mM)
Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Caractéristiques |
Approximately 10-fold selectivity toward BACE1 over BACE2.
|
|---|---|
| Targets/IC50/Ki |
BACE1
239 nM-249 nM
Aβ
~300 nM(EC50)
|
| In vitro |
LY2811376 démontre une inhibition dépendante de la concentration de hBACE1 avec une IC50 de 239 et 249 nM contre un petit peptide synthétique ou un substrat protéique chimérique plus grand, respectivement. Le traitement avec ce composé entraîne une diminution dépendante de la concentration de la sécrétion d'Aβ dans les cellules HEK293 surexprimant l'APP. Il inhibe la sécrétion d'Aβ avec une EC50 d'environ 100 nM dans les cultures neuronales primaires de souris transgéniques PDAPP.
|
| Essai kinase |
Détermination de l'efficacité enzymatique
|
|
La solution stock de chaque substrat peptidique FRET est préparée à 30 mM dans du diméthylsulfoxyde (DMSO). La préparation huBACE1:Fc muBACE1:Fc est concentrée via Centricon YM10. à une concentration finale d'au moins 7 mg/mL. La concentration enzymatique optimale pour chaque substrat peptidique FRET est déterminée individuellement à 30μM de substrat peptidique FRET dans 50 mM d'acétate d'ammonium, pH 4,6, 1 mg/mL de BSA et 1 mM de Triton X-100. L'efficacité enzymatique (kcat /Km) de l'un ou l'autre des orthologues de BACE1 envers des substrats peptidiques FRET individuels à 15, 30 et 100μM est déterminée dans les conditions optimales pour chaque substrat. Le déroulement de la réaction est surveillé en mesurant une augmentation du signal d'émission à 420 nm avec une longueur d'onde d'excitation réglée à 320 nm, à l'aide d'un lecteur de plaque de fluorescence GEMINI. L'aminobenzoate conjugué aux acides aminés est utilisé pour convertir le signal d'émission en unités de fluorescence relative en concentration molaire de produit généré dans le mélange réactionnel. La phase initiale de la courbe de dépendance temporelle est ajustée avec une fonction linéaire dont la pente est utilisée pour calculer le taux initial pour huBACE1:Fc envers chaque substrat peptidique. Les valeurs de kcat /Km sont calculées à partir de la dépendance linéaire du taux initial sur la concentration de chaque peptide.
|
|
| In vivo |
L'administration de LY2811376 (doses de 10, 30 et 100 mg/kg) entraîne des réductions significatives et dose-dépendantes de l'Aβ, ainsi que du sAPPβ et du C99, les produits de clivage proximaux de la protéolyse de l'APP par BACE1 dans le modèle murin APPV717F de pathologie Aβ. Après traitement avec ce composé (5 mg/kg), des réductions de l'Aβ1-x sont observées dans le plasma, avec une réduction maximale de 85 % observée de 4 à 12 h après l'administration chez les chiens beagle.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT00838084 | Completed | Alzheimer''s Disease |
Eli Lilly and Company |
December 2008 | Phase 1 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
