pour la recherche uniquement
Guanabenz Acetate Adrenergic Receptor agoniste
Réf. CatalogueS4065
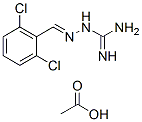
Structure chimique
Poids moléculaire: 291.13
Contrôle Qualité
| Cibles apparentées | AChR 5-HT Receptor COX Calcium Channel Histamine Receptor Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) GluR |
|---|---|
| Autre Adrenergic Receptor Inhibiteurs | ICI 118551 Hydrochloride (Zenidolol) L755507 Yohimbine HCl Atipamezole Naftopidil Detomidine HCl Higenamine hydrochloride Adrenalone HCl Medetomidine HCl Deoxycorticosterone acetate |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 291.13 | Formule | C8H8Cl2N4.C2H4O2 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 23256-50-0 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | WY-8678 Acetate | Smiles | CC(=O)O.C1=CC(=C(C(=C1)Cl)C=NN=C(N)N)Cl | ||
Solubilité
|
In vitro |
DMSO
: 15 mg/mL
(51.52 mM)
Ethanol : 15 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
α2a-adrenergic receptor
8.25(pEC50)
α2b-adrenergic receptor
7.01(pEC50)
α2c-adrenergic receptor
<5(pEC50)
|
|---|---|
| In vitro |
Le Guanabenz à une concentration de 30 μM provoque une perte de l'activité nNOS dépendante du temps, présente dans le cytosol préparé à partir de cellules HEK 293 transfectées avec nNOS de rat, avec un Ki de 1 μM. Le Guanabenz peut induire une perte de l'activité nNOS dépendante de la concentration. Au cours des 3 premières heures de traitement, 50 μM de Guanabenz diminue l'accumulation de nitrite et de nitrate d'environ 75 % dans les cellules. Le traitement de cellules HEK 293 pendant 24 h avec du Guanabenz (100 μM) provoque une diminution d'environ 35 % de la quantité de protéine nNOS immunodétectable. Le Guanabenz améliore la protéolyse de la protéine, la demi-vie diminuant de moitié, passant de 20 à 10 h.
Le Guanabenz est actif contre le prion [ PSI+] dans l'essai basé sur la levure, indépendamment de son activité agoniste sur les récepteurs α2-adrenergic receptors. Le Guanabenz (10 μM) favorise une clairance complète de PrPSc dans l'essai basé sur les cellules de mammifères MovS6.
|
| In vivo |
Le Guanabenz injecté par voie intraveineuse à des doses de 0,1 mg/kg provoque une augmentation initiale de la pression artérielle suivie d'une chute prolongée et d'une diminution du débit cardiaque, de la force contractile et de la fréquence cardiaque chez les chiens anesthésiés, ce qui nécessite la présence d'un tonus sympathique. Le Guanabenz inhibe les réponses pressives à diverses procédures qui déclenchent une décharge sympathique générale. Le Guanabenz antagonise également les réponses à la stimulation du nerf sympathique. Le Guanabenz injecté à des doses de 0,5 mg/kg et plus abaisse la pression artérielle et la fréquence cardiaque chez les rats et les chiens hypertendus non anesthésiés.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT02423083 | Terminated | Multiple Sclerosis Relapsing-Remitting|Multiple Sclerosis |
National Institute of Neurological Disorders and Stroke (NINDS)|National Institutes of Health Clinical Center (CC) |
April 21 2015 | Phase 1 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
