pour la recherche uniquement
LDN-57444 DUB inhibiteur
Réf. CatalogueS7135
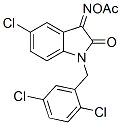
Structure chimique
Poids moléculaire: 397.64
Contrôle Qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- SDS
- Fiche technique
| Cibles apparentées | HDAC Caspase Proteasome Secretase MMP HCV Protease Cysteine Protease DPP Tyrosinase HIV Protease |
|---|---|
| Autre DUB Inhibiteurs | PR-619 P5091 IU1 P22077 b-AP15 ML323 VLX1570 TCID EOAI3402143 ML364 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 397.64 | Formule | C17H11Cl3N2O3 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 668467-91-2 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CC(=O)ON=C1C2=C(C=CC(=C2)Cl)N(C1=O)CC3=C(C=CC(=C3)Cl)Cl | ||
Solubilité
|
In vitro |
DMSO
: 11 mg/mL
(27.66 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
UCH-L1
0.4 μM(Ki)
UCH-L1
0.88 μM
UCH-L3
25 μM
|
|---|---|
| In vitro |
Le traitement avec 50 μM de LDN-57444 pendant 24 h entraîne une inhibition de 70 % de l'activité du protéasome. Ce composé provoque une diminution significative et dose-dépendante de la viabilité cellulaire à des concentrations supérieures à 25 μM, et la viabilité cellulaire est réduite à 61,81 % à 50 μM. Il est capable de provoquer la mort cellulaire par la voie de l'apoptose en diminuant l'activité du système ubiquitine protéasome et en augmentant les niveaux de protéines fortement ubiquitinylées, ce qui peut activer la réponse aux protéines mal repliées. L'apoptose induite par cette substance chimique peut être déclenchée par l'activation du stress du réticulum endoplasmique (ERS).
|
| Essai kinase |
Criblage HTS
|
|
Pour démarrer un dosage, 0,5 μL de composé d'essai à 5 mg/mL (environ 50 μM de concentration de réaction finale) ou de contrôle DMSO sont aliquotes dans chaque puits. L'enzyme et le substrat sont préparés dans le tampon de réaction UCH (50 mM Tris-HCl [pH 7,6], 0,5 mM EDTA, 5 mM DTT et 0,5 mg/mL d'ovalbumine). 25 μL de 0,6 nM UCH-L1 sont ensuite ajoutés à chaque puits, à l'exception des puits de contrôle du substrat, suivis d'une agitation de la plaque pendant 45 à 60 s sur un agitateur automatique. Le mélange enzyme/composé est incubé à température ambiante pendant 30 min avant l'ajout de 25 μL de 200 nM Ub-AMC pour initier la réaction enzymatique. Le mélange réactionnel (300 pM UCH-L1, 100 nM Ubiquitin-AMC avec 2,5 μg de composé d'essai) est incubé à température ambiante pendant 30 minutes supplémentaires avant d'arrêter la réaction par l'ajout de 10 μL d'acide acétique 500 mM par puits. L'intensité d'émission de fluorescence est mesurée sur un LJL Analyst à l'aide d'un ensemble de filtres à la coumarine (ex = 365 nm, em = 450 nm) et est soustraite de la fluorescence intrinsèque du composé pour révéler l'activité enzymatique. Un contrôle DMSO (0,5 μL de DMSO, 25 μL d'UCH-L1, 25 μL d'ubiquitine-AMC, 10 μL d'acide acétique), un contrôle enzymatique (25 μL d'UCH-L1, 25 μL de tampon, 10 μL d'acide acétique), un contrôle de substrat (25 μL de tampon, 25 μL d'ubiquitine-AMC, 10 μL d'acide acétique) et un contrôle inhibiteur (0,5 μL d'aldéhyde d'ubiquitine [stock 100 nM], 25 μL d'UCH-L1, 25 μL d'ubiquitine-AMC, 10 μL d'acide acétique) sont également réalisés dans chaque plaque d'essai pour assurer la qualité et la reproductibilité. Les inhibiteurs potentiels d'UCH-L1 sont sélectionnés si les composés ont démontré une inhibition supérieure à 60 % par rapport aux contrôles. Les réactions enzymatiques d'UCH-L1 sont répétées manuellement deux fois en utilisant le même protocole pour confirmer les résultats des composés « hit » du criblage robotisé primaire.
|
|
| In vivo |
LDN-57444 provoque des altérations dramatiques de la distribution des protéines synaptiques et de la morphologie des épines in vivo. Le traitement avec ce composé entraîne également une chute rapide de l'activité de l'Uch-L1, mais l'inhibition du protéasome n'a aucun effet sur les niveaux de cAMP sur une période de plusieurs heures.
|
Références |
|
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
