pour la recherche uniquement
AG-18 EGFR Inhibiteur
Réf. CatalogueS8009
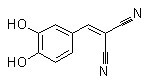
Structure chimique
Poids moléculaire: 186.17
Contrôle Qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- HPLC
- SDS
- Fiche technique
| Cibles apparentées | VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Autre EGFR Inhibiteurs | Lazertinib (YH25448) Icotinib Hydrochloride Sunvozertinib AG-490 AG-1478 Canertinib (CI-1033) WZ4002 Rociletinib (CO-1686) Poziotinib (NOV120101, HM781-36B) Genistein |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 186.17 | Formule |
C10H6N2O2
|
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 118409-57-7 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | RG-50810, Tyrphostin A23, TX 825 | Smiles | C1=CC(=C(C=C1C=C(C#N)C#N)O)O | ||
Solubilité
|
In vitro |
DMSO
: 37 mg/mL
(198.74 mM)
Ethanol : 37 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
EGFR
35 μM
|
|---|---|
| In vitro |
AG 18 inhibe EGFR et IR avec des Ki de 11 μM et 12 mM. AG 18 inhibe l'autophosphorylation de l'EGFR induite par l'EGF avec une IC50 de 15 μM dans les cellules A431. AG 18 (10 μM) inhibe la prolifération des cellules GH3 induite par l'EGF. AG 18 (10 μM) provoque une inhibition significative de la prolifération cellulaire induite par 10 nM et 1 μM de ghréline. AG 18 (10 μM) bloque l'augmentation de la phosphorylation d'ERK 1/2 stimulée par la ghréline dans les cellules GH3. AG 18 inhibe la libération de [3H]taurine sensible au volume dans les cultures d'astrocytes primaires de manière dose-dépendante. AG 18 active la libération de D-[3H]aspartate dépendante du volume et induite par le gonflement à partir de cultures d'astrocytes primaires. AG 18 (300 μM) inhibe la stimulation de l'expression d'ICAM-1 induite par le TPA de manière dose-dépendante dans les cellules épithéliales A549. AG 18 (300 μM) inhibe également la liaison ADN-protéine de NF-kappaB stimulée par le TPA et l'activité promotrice d'ICAM-1 dans les cellules épithéliales A549. AG 18 (300 μM) inhibe la liaison ADN-protéine de NF-kappaB induite par le TNF-alpha et l'activité promotrice d'ICAM-1 de manière dose-dépendante dans les cellules épithéliales A549. L'activité IKK est stimulée à la fois par le TNF-alpha et le TPA, et ces effets sont inhibés par AG 18 (100 μM) dans les cellules épithéliales A549. AG 18 (10 μM) diminue la puissance du 5-HT de 4 fois et réduit la contraction maximale du 5-HT dans l'artère carotide. AG 18 (10 μM) décale la contraction induite par le KCl de 2 fois et provoque l'inhibition maximale significative.
|
| Essai kinase |
Autophosphorylation du récepteur d'EGF
|
|
Le récepteur d'EGF purifié par WGA à partir de cellules A431 (0,5 μg/essai) est activé avec l'EGF (800 nM) pendant 20 min à 4 °C. La réaction est initiée par l'addition de Mg(Ac)2 (60 mM), de tampon Tris-Mes, pH 7,6 (50 mM), et de [32P]ATP (20 pM, 5 μCi/essai). La réaction est menée soit à 4 °C, soit à 15 °C et terminée par l'addition de tampon d'échantillon de dodécylsulfate de sodium (SDS) (10 % de glycérol, 50 mM Tris, pH 6,8, 5 % de β-mercaptoéthanol et 3 % de SDS). Les échantillons sont soumis à une électrophorèse sur gel de polyacrylamide à 8 % de SDS (SDS-PAGE) (préparé à partir de 30 % d'acrylamide et 0,8 % de bis-(acrylamide) et contenant 0,375 M Tris, pH 8,8, 0,1 % de SDS, 0,05 % de TEMED et 0,46 % de persulfate d'ammonium). Le gel est séché et une autoradiographie est réalisée avec un film radiographique Agfa Curix RP2. Les bandes radioactives pertinentes sont découpées et comptées en mode Cerenkov. La phase rapide d'autophosphorylation s'est poursuivie pendant encore 10 min. L'étendue de la phosphorylation achevée dans les 10 premières secondes à 15 °C représente 1/3 du signal total d'autophosphorylation et reflète probablement la phosphorylation du premier site sur le récepteur. L'intervalle de 10 secondes est donc choisi pour être utilisé dans les expériences d'autophosphorylation ultérieures.
|
Références |
|
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
