pour la recherche uniquement
Crizotinib hydrochloride c-Met inhibiteur
Réf. CatalogueS5190
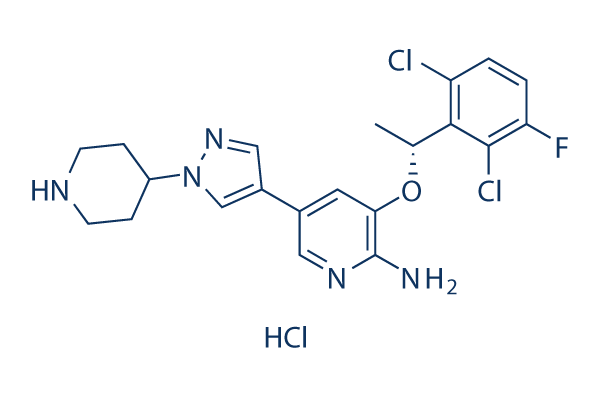
Structure chimique
Poids moléculaire: 486.8
Contrôle Qualité
| Cibles apparentées | EGFR VEGFR PDGFR FGFR Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Autre c-Met Inhibiteurs | Tepotinib Dihexa SGX-523 PHA-665752 Foretinib SU11274 BMS-777607 JNJ-38877605 Tivantinib PF-04217903 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 486.8 | Formule | C21H23Cl3FN5O |
Stockage (À compter de la date de réception) | 3 years -20°C powder |
|---|---|---|---|---|---|
| N° CAS | 1415560-69-8 | -- | Stockage des solutions mères |
|
|
| Synonymes | Xalkori, PF-02341066 hydrochloride | Smiles | Cl.CC(OC1=C(N)N=CC(=C1)C2=C[N](N=C2)C3CCNCC3)C4=C(Cl)C=CC(=C4Cl)F | ||
Solubilité
|
In vitro |
DMSO
: 97 mg/mL
(199.26 mM)
Water : 97 mg/mL Ethanol : 97 mg/mL |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
ROS1
(Cell-free assay) <0.025 nM(Ki)
c-Met
(Cell-based assay) 11 nM
NPM-ALK
(Cell-based assay) 24 nM
|
|---|---|
| In vitro |
Le PF-2341066 présente une puissance similaire contre la phosphorylation de c-Met dans les cellules épithéliales de souris mIMCD3 ou canines MDCK avec des IC50 de 5 nM et 20 nM, respectivement. Le PF-2341066 montre une activité améliorée ou similaire contre les cellules NIH3T3 conçues pour exprimer les mutants V1092I ou H1094R du site de liaison de l'ATP de c-Met ou le mutant de la boucle P M1250T avec des IC50 de 19 nM, 2 nM et 15 nM, respectivement, comparativement aux cellules NIH3T3 exprimant le récepteur de type sauvage avec un IC50 de 13 nM. En revanche, un décalage marqué de la puissance du PF-2341066 est observé contre les cellules conçues pour exprimer les mutants de la boucle d'activation de c-Met Y1230C et Y1235D avec des IC50 de 127 nM et 92 nM, respectivement, comparativement au récepteur de type sauvage. Le PF-2341066 prévient également puissamment la phosphorylation de c-Met dans les cellules NCI-H69 et HOP92, avec des IC50 de 13 nM et 16 nM, respectivement, qui expriment les variants endogènes de c-Met R988C et T1010I, respectivement. Le PF-2341066 est >1 000 fois sélectif pour les RTK VEGFR2 et PDGFRβ, >250 fois sélectif pour IRK et Lck, et ~40 à 60 fois sélectif pour Tie2, TrkA et TrkB, tous comparativement à c-Met. Le PF-2341066 est 20 à 30 fois sélectif pour les RTK RON et Axl. En revanche, le PF-2341066 présente un IC50 quasi équivalent de 24 nM contre le variant de fusion oncogénique de l'ALK RTK, nucléophosmine (NPM)-anaplastic lymphoma kinase (ALK), exprimé par la lignée cellulaire de lymphome anaplasique à grandes cellules humaines (ALCL) KARPAS299. Le PF-2341066 inhibe les phénotypes néoplasiques dépendants de c-Met des cellules cancéreuses et les phénotypes angiogéniques des cellules endothéliales. Le PF-2341066 supprime la croissance des cellules de carcinome gastrique humain GTL-16 avec un IC50 de 9,7 nM. Le PF-2341066 induit l'apoptose dans les cellules GTL-16 avec un IC50 de 8,4 nM. Le PF-2341066 inhibe la migration et l'invasion des cellules de carcinome pulmonaire humain NCI-H441 stimulées par le HGF avec des IC50 de 11 nM et 6,1 nM, respectivement. Le PF-2341066 inhibe la dispersion des cellules MDCK avec un IC50 de 16 nM. Le PF-2341066 prévient la phosphorylation de c-Met stimulée par le HGF, la survie cellulaire et l'invasion du Matrigel avec des IC50 de 11 nM, 14 nM et 35 nM, respectivement. De plus, le PF-2341066 prévient la tubulogenèse de ramification des HMVEC stimulée par le sérum (formation de tubes vasculaires) dans les gels de fibrine. |
| Essai kinase |
Tests ELISA de phosphorylation de kinase cellulaire
|
|
Les cellules sont ensemencées dans des plaques à 96 puits dans des milieux supplémentés avec 10 % de sérum de veau fœtal (FBS) et transférées dans un milieu sans sérum [avec 0,04 % d'albumine de sérum bovin (BSA)] après 24 h. Dans les expériences étudiant la phosphorylation de RTK dépendante du ligand, les facteurs de croissance correspondants sont ajoutés pendant une durée maximale de 20 min. Après incubation des cellules avec le PF-2341066 pendant 1 h et/ou des ligands appropriés pendant les temps désignés, les cellules sont lavées une fois avec du HBSS supplémenté avec 1 mM de Na3VO4, et des lysats protéiques sont générés à partir des cellules. Par la suite, la phosphorylation des Protein Tyrosine Kinase sélectionnées est évaluée par une méthode ELISA en sandwich utilisant des anticorps de capture spécifiques utilisés pour enrober les plaques à 96 puits et un anticorps de détection spécifique pour les résidus de tyrosine phosphorylés. Les plaques revêtues d'anticorps sont (a) incubées en présence de lysats protéiques à 4 °C pendant une nuit ; (b) lavées sept fois dans 1 % de Tween 20 dans du PBS ; (c) incubées dans un anticorps anti-phosphotyrosine totale (PY-20) conjugué à la peroxydase de raifort (1:500) pendant 30 min ; (d) lavées à nouveau sept fois ; (e) incubées dans un substrat de peroxydase 3,3′,5,5′-tétraméthylbenzidine pour initier une réaction colorimétrique qui est arrêtée par l'ajout de 0,09 N H2SO4 ; et (f) l'absorbance est mesurée à 450 nm à l'aide d'un spectrophotomètre.
|
|
| In vivo |
Dans le modèle GTL-16, le PF-2341066 révèle la capacité à provoquer une régression marquée des grosses tumeurs établies (>600 mm3) dans les deux cohortes de traitement de 50 mg/kg/jour et 75 mg/kg/jour, avec une diminution de 60 % du volume tumoral moyen sur le programme d'administration de 43 jours. Dans une autre étude, le PF-2341066 montre la capacité à inhiber complètement la croissance tumorale du GTL-16 pendant >3 mois, avec seulement 1 souris sur 12 présentant une augmentation significative de la croissance tumorale sur le programme de traitement de 3 mois à 50 mg/kg/jour. Dans le modèle NSCLC NCI-H441, une diminution de 43 % du volume tumoral moyen est observée à 50 mg/kg/jour pendant le cycle d'administration de PF-2341066 de 38 jours. Dans le modèle RCC Caki-1, une diminution de 53 % du volume tumoral moyen est associée à une diminution du volume de chaque tumeur d'au moins 30 % à 50 mg/kg/jour pendant le cycle d'administration de PF-2341066 de 33 jours. Le PF-2341066 révèle également une prévention quasi complète de la croissance des tumeurs établies à 50 mg/kg/jour dans les modèles de xénogreffes de glioblastome U87MG ou de carcinome prostatique PC-3, avec une inhibition de 97 % ou 84 % au dernier jour de l'étude, respectivement. En revanche, le PF-2341066 administré par voie orale à 50 mg/kg/jour n'inhibe pas significativement la croissance tumorale dans le modèle de carcinome mammaire MDA-MB-231 ou le modèle de carcinome du côlon DLD-1. Une réduction significative dose-dépendante des cellules endothéliales positives au CD31 est observée à 12,5 mg/kg/jour, 25 mg/kg/jour et 50 mg/kg/jour dans les tumeurs GTL-16, indiquant que l'inhibition de la MVD montre une corrélation dose-dépendante avec l'efficacité antitumorale. Le PF-2341066 montre une réduction significative dose-dépendante des taux plasmatiques humains de VEGFA et d'IL-8 dans les modèles GTL-16 et U87MG. Une inhibition marquée des taux de c-Met, Akt, Erk, PLCλ1 et STAT5 phosphorylés est observée dans les tumeurs GTL-16 après administration orale de PF-2341066.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT06062810 | Not yet recruiting | Non-Small Cell Lung Cancer |
Han Xu M.D. Ph.D. FAPCR Sponsor-Investigator IRB Chair|Medicine Invention Design Inc |
March 28 2024 | Phase 2|Phase 3 |
| NCT04148066 | Completed | Carcinoma Non-Small-Cell Lung |
The Netherlands Cancer Institute|Roche Pharma AG |
July 17 2019 | Not Applicable |
| NCT03947385 | Recruiting | Metastatic Uveal Melanoma|Cutaneous Melanoma|Colorectal Cancer|Other Solid Tumors |
IDEAYA Biosciences |
June 28 2019 | Phase 1|Phase 2 |
| NCT03672643 | Terminated | ALK or ROS1-positive NSCLC |
Pfizer |
January 28 2019 | Phase 4 |
| NCT03439215 | Unknown status | Carcinoma Non-Small-Cell Lung |
Fondazione Ricerca Traslazionale|Clinical research technology Srl |
June 13 2017 | Phase 2 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
