pour la recherche uniquement
Cycloastragenol Telomerase activateur
Réf. CatalogueS3894
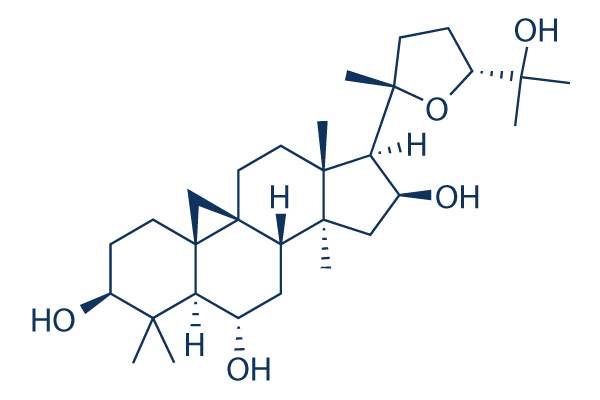
Structure chimique
Poids moléculaire: 490.72
Contrôle Qualité
| Cibles apparentées | HDAC PARP ATM/ATR DNA-PK WRN DNA/RNA Synthesis Topoisomerase PPAR Sirtuin Casein Kinase |
|---|---|
| Autre Telomerase Inhibiteurs | EGCG ((-)-Epigallocatechin Gallate) BIBR 1532 Costunolide RHPS 4 methosulfate Cyclogalegenol Epitalon MST-312 L-778123 hydrochloride TAC (TERT Activator-1) Braco-19 trihydrochloride |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 490.72 | Formule | C30H50O5 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 84605-18-5 | -- | Stockage des solutions mères |
|
|
| Synonymes | CAG, TA-65, Cyclogalegigenin, Astramembrangenin | Smiles | CC1(C(CCC23C1C(CC4C2(C3)CCC5(C4(CC(C5C6(CCC(O6)C(C)(C)O)C)O)C)C)O)O)C | ||
Solubilité
|
In vitro |
DMSO
: 98 mg/mL
(199.7 mM)
Ethanol : 25 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
telomerase
|
|---|---|
| In vitro |
Le Cycloastragenol stimule l'activité de la télomérase et la prolifération cellulaire dans les kératinocytes néonatals humains. Il induit l'activité de la télomérase et l'activation de l'élément de réponse au cAMP (CREB) dans les cellules PC12 et les neurones primaires. Le traitement par ce composé n'induit pas seulement l'expression de bcl2, un gène régulé par CREB, mais aussi l'expression de la télomérase inverse transcriptase dans les neurones corticaux primaires. Il traverse rapidement la monocouche de cellules Caco-2 par diffusion passive. Une fois le passage à travers l'épithélium intestinal effectué, un métabolisme intestinal de premier passage de ce produit chimique pourrait se produire. Il peut subir un métabolisme étendu dans les microsomes hépatiques de rat et humains.
|
| In vivo |
L'administration orale de Cycloastragenol (CA) pendant 7 jours atténue les comportements de type dépressif chez les souris expérimentales. La biodisponibilité orale de ce composé est d'environ 25,70 % à 10 mg/kg. Il est excrété par la bile et les fèces et éliminé principalement par les reins chez les rats. Il pourrait également exister une circulation entérohépatique de ce produit chimique chez les rats. Il pourrait être largement métabolisé in vivo chez le rat. Pour une administration orale, la Tmax moyenne à 10 mg/kg, 20 mg/kg et 40 mg/kg est de 2,06±0,58 h, 1,48±0,36 h et 2,35±1,17 h. La t1/2 est respectivement de 5,23±1,55 h, 7,33±3,03 h et 6,06±3,42 h. Le temps d'absorption moyen de ce composé à 10 mg/kg est de 5,70±1,62 h ; la faible absorption pourrait être due à la faible solubilité. Les paramètres pharmacocinétiques ne montrent pas de différences significatives entre les groupes de 10, 20 et 40 mg/kg, à l'exception de la Cmax et de l'AUC.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT05777083 | Recruiting | ST Elevation Myocardial Infarction|Electrocardiogram |
Ewha Womans University Mokdong Hospital |
January 1 2023 | Not Applicable |
| NCT05578443 | Recruiting | Alzheimer''s Disease |
Fujian Medical University Union Hospital |
October 1 2022 | Phase 2 |
| NCT05528744 | Recruiting | Genetic Disease|Chopra-Amiel-Gordon Syndrome|CAGS|ANKRD17 |
Boston Children''s Hospital |
August 27 2022 | -- |
| NCT05533528 | Recruiting | Periodontal Pocket|Periodontal Diseases|Periodontal Bone Loss |
Universidad de Murcia |
May 3 2022 | Not Applicable |
| NCT05118009 | Completed | Myocardial Infarction Acute |
National Defense Medical Center Taiwan |
May 1 2022 | Not Applicable |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
