pour la recherche uniquement
Tiplaxtinin (PAI-039) PAI-1 inhibiteur
Réf. CatalogueS7922
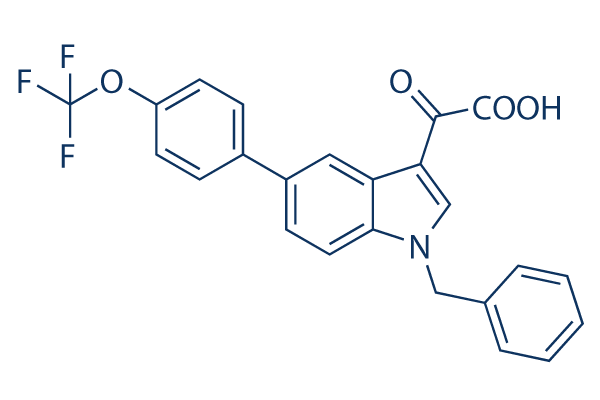
Structure chimique
Poids moléculaire: 439.38
Contrôle Qualité
| Cibles apparentées | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Autre PAI-1 Inhibiteurs | Notoginsenoside R1 Loureirin B Toddalolactone TM5275 Sodium TM5441 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 439.38 | Formule | C24H16F3NO4 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 393105-53-8 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | C1=CC=C(C=C1)CN2C=C(C3=C2C=CC(=C3)C4=CC=C(C=C4)OC(F)(F)F)C(=O)C(=O)O | ||
Solubilité
|
In vitro |
DMSO
: 88 mg/mL
(200.28 mM)
Ethanol : 7 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
PAI-1
2.7 μM
|
|---|---|
| In vitro |
Tiplaxtinin (PAI-039) réduit la prolifération cellulaire, l'adhésion cellulaire et la formation de colonies, et induit l'apoptose et l'anoïkis dans un panel de lignées cellulaires de vessie humaine.
|
| Essai kinase |
Tests d'activité in vitro directe de PAI-I
|
|
L'essai chromogène est initié par l'ajout de Tiplaxtinin (PAI-039) (concentration finale de 10 à 100 µM, concentration maximale de DMSO de 0,2%) à du PAI-1 humain recombinant (140 nM dans un tampon pH 6,6). Après une incubation de 15 minutes à 25°C, 70 nM de t-PA humain recombinant sont ajoutés, et la combinaison de ce composé, PAI-1 et tPA est incubée pendant 30 minutes supplémentaires. Après la deuxième incubation, du Spectrozyme tPA est ajouté et l'absorbance est lue à 405 nm à 0 et 60 minutes. L'activité inhibitrice relative du PAI-1 est égale à l'activité résiduelle du tPA dans le traitement au Tiplaxtinin/PAI-1. Les traitements témoins incluent l'inhibition complète du tPA par le PAI-1 au rapport molaire utilisé (2:1), et l'absence de tout effet sur le t-PA seul. L'essai immunofonctionnel est basé sur l'interaction non dissociable par le SDS entre le tPA et le PAI-1 actif. Les plaques d'essai sont recouvertes de 100 µl d'une solution de t-PA (10 µg/ml dans du TBS), et conservées à 4°C pendant une nuit. Ce composé est dissous dans du DMSO et dilué à une concentration finale de 1-100 µM comme décrit ci-dessus. Il est ensuite incubé avec du PAI-1 humain (50 ng/ml) pendant 15 minutes, et une aliquote de cette solution est ajoutée à la plaque recouverte de t-PA pendant 1 heure. La solution est aspirée de la plaque, qui est ensuite lavée avec un tampon composé de 0,05% de Tween 20 et 0,1% de BSA dans du TBS. Cet essai détecte uniquement le PAI-1 actif inhibiteur (non latent ou substrat) lié à la plaque, et est quantifié à l'aide d'un anticorps monoclonal dirigé contre le PAI-1 humain (MA33B8). Une dilution au 1000X de MA33B8 est ajoutée à la plaque et incubée pendant une heure, aspirée et lavée. Un anticorps secondaire composé d'un conjugué de phosphatase alcaline de chèvre anti-souris IgG (H+L)-AP est ajouté, incubé pendant une heure, aspiré et lavé. Une aliquote de 100 µl de solution de phosphatase alcaline est ajoutée, suivie de la détermination de l'absorbance à 405 nm 60 minutes plus tard. La quantification du PAI-1 actif résiduel lié au t-PA à différentes concentrations est utilisée pour déterminer l'IC50 en ajustant les résultats à un programme de dose-réponse logistique, l'IC50 étant définie comme la concentration du composé nécessaire pour atteindre 50% d'inhibition de l'activité du PAI-1. La sensibilité de l'essai est de 5 ng/ml de PAI-1 humain, déterminée à partir d'une courbe standard allant de 0 à 100 ng/ml de PAI-1 humain.
|
|
| In vivo |
Il a été démontré dans de multiples études que Tiplaxtinin (PAI-039) présente divers effets biologiques. Dans un modèle de thrombose carotidienne chez le rat, il (1 mg/kg, p.o.) augmente le temps jusqu'à l'occlusion et prévient la réduction du flux sanguin carotidien. Chez les souris C57BL/6J, (1 mg/g de nourriture) il atténue le remodelage aortique induit par l'Ang II. Chez les souris diabétiques de type 1 non traitées, ce composé (p.o.) restaure la régénération musculaire squelettique. Chez les souris athymiques portant des xénogreffes de lignées cellulaires cancéreuses humaines T24 et HeLa, il (1 mg/kg, p.o.) réduit la croissance des xénogreffes tumorales, associée à une réduction de l'angiogenèse tumorale, une réduction de la prolifération cellulaire et une augmentation de l'apoptose.
|
Références |
|
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
