pour la recherche uniquement
(R)-(-)-Gossypol (AT-101) acetic acid Bcl-2 inhibiteur
Réf. CatalogueS2812
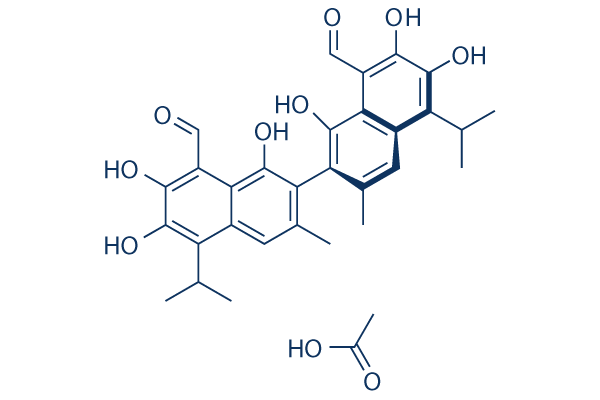
Structure chimique
Poids moléculaire: 578.61
Contrôle Qualité
| Cibles apparentées | Caspase PD-1/PD-L1 Ferroptosis p53 Apoptosis related Synthetic Lethality STAT TNF-alpha Ras KRas |
|---|---|
| Autre Bcl-2 Inhibiteurs | Navitoclax (ABT-263) S63845 ABT-737 Obatoclax Mesylate (GX15-070) A-1331852 A-1210477 TW-37 A-1155463 Dihydrochloride AZD5991 UMI-77 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 578.61 | Formule | C30H30O8.C2H4O2 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 866541-93-7 | Télécharger le SDF | Stockage des solutions mères |
|
|
Solubilité
|
In vitro |
DMSO
: 100 mg/mL
(172.82 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
Mcl-1
(Cell-free assay) 0.18 μM(Ki)
Bcl-2
(Cell-free assay) 0.32 μM(Ki)
Bcl-xL
(Cell-free assay) 0.48 μM(Ki)
|
|---|---|
| In vitro |
L'AT-101 inhibe un panel de différentes hémopathies lymphoprolifératives avec une IC50 allant de 1,2 μM à 7,4 μM. L'AT-101 (10 μM) perturbe le Δψm de manière concentration- et temps-dépendante dans des lignées de lymphome diffus à grandes cellules B et de lymphome à cellules du manteau. L'AT-101 (1 μM ou 2 μM) combiné au carfilzomib (6 nM ou 10 nM) induit l'apoptose dans les lignées cellulaires HBL-2 et Granta. L'AT-101 (20 μM pendant 24 heures) entraîne une apoptose médiane de 72 % et une régulation à la baisse de Mcl-1 dans les lymphocytes de LLC en culture en suspension ainsi qu'en coculture stromale. Les cellules stromales expriment des niveaux indétectables d'antiapoptotiques, mais des niveaux élevés de protéines ERK et AKT activées et présentent peu ou pas d'apoptose avec l'AT-101. L'AT-101 induit l'apoptose de manière temps- et dose-dépendante, avec des valeurs ED50 de 1,9 mM et 2,4 mM dans les cellules Jurkat T et U937, respectivement. L'AT-101 (10 μM) combiné à la radiation (32 Gy) induit plus d'apoptose que la radiation seule et dépasse la somme des effets causés par les traitements par agent unique. L'AT-101 active SAPK/JNK de manière dose- et temps-dépendante. L'AT-101 (10 µM) induit l'apoptose par l'activation des caspases-9, -3 et -7 dans les cellules VCaP. L'AT-101 (10 µM) diminue l'expression de Bcl-2 et Mcl-1 dans les cellules VCaP. L'AT-101 (< 20 μM) est capable d'inhiber la croissance des cellules de myélome multiple malgré les effets de croissance stimulateurs fournis par les cellules stromales dans le milieu de la moelle osseuse. L'AT-101 (10 μM) induit l'apoptose dans les cellules de myélome multiple via l'activation des caspases 3, des caspases 9 et de la PARP. L'AT-101 (10 μM) favorise l'apoptose dans les cellules de myélome multiple en perturbant le rapport Bax/Bcl-2 et le potentiel de membrane mitochondrial.
|
| Essai kinase |
Essai de liaison basé sur la polarisation de fluorescence
|
|
Pour les expériences de liaison compétitive, la protéine Bcl-2 (40 nM) et le peptide FAM-Bid (2,5 nM) sont préincubés dans le tampon d'essai (100 mM phosphate de potassium, pH 7,5 ; 100 μg/mL globuline gamma bovine ; 0,02 % d'azide de sodium). 5 μL d'une solution d'AT101 dans du DMSO sont ajoutés à la solution de Bcl-2/FAM-Bid dans des plaques Dynex à 96 puits, noires, à fond rond pour produire un volume final de 125 μL. Pour chaque expérience, un contrôle contenant Bcl-2 et le peptide Flu-Bid (équivalent à 0 % d'inhibition), et un autre contrôle contenant uniquement le FAM-Bid, sont inclus sur chaque plaque d'essai. Après 4 heures d'incubation, les valeurs de polarisation en unités de millipolarisation (mP) sont mesurées à une longueur d'onde d'excitation de 485 nm et une longueur d'onde d'émission de 530 nm à l'aide du lecteur de plaques Ultra. L'IC50, la concentration d'inhibiteur à laquelle 50 % du peptide lié est déplacé, est déterminée à partir du graphique à l'aide d'une analyse des moindres carrés non linéaires et d'un ajustement de courbe effectué à l'aide du logiciel GraphPad Prizm 4. Le peptide Bid BH3 non marqué est utilisé comme contrôle positif. PF pour la protéine Bcl-xL, le peptide Bak BH3 marqué avec de l'ester de succinimidyle de 6-carboxyfluorescéine (FAM-Bak) au lieu du FAM-Bim pour maximiser le signal. Il est déterminé que le FAM-Bak a un Kd de 6 nM pour la protéine Bcl-xL. L'essai de liaison compétitive pour Bcl-xL est le même que celui pour Bcl-2 avec les exceptions suivantes : 30 nM de protéine Bcl-xL et 2,5 nM de peptide FAM-Bak dans le tampon d'essai suivant : 50 mM Tris-Bis, pH 7,4 et 0,01 % de globuline gamma bovine. PF pour la protéine Mcl-1, le peptide FAM-Bid et la protéine Mcl-1 humaine sont utilisés. Il est déterminé que le peptide FAM-Bid se lie à la protéine Mcl-1 humaine avec un Kd de 1,71 nM. Les essais de liaison compétitive pour Mcl-1 sont effectués de la même manière que ceux pour Bcl-2 avec les exceptions suivantes : 5 nM de Mcl-1 et 1 nM de peptide Flu-Bid dans le tampon d'essai suivant : 25 mM Tris, pH 8,0 ; 150 mM NaCl et 0,05 % d'acide Pluronic.
|
|
| In vivo |
L'AT-101 est toujours détectable dans le plasma avec des concentrations moyennes de 0,49 μM pour le groupe 35 mg/kg et 0,39 μM pour le groupe 200 mg/kg chez des souris SCID beige porteuses d'un xénogreffe de RL-DLBCL. La concentration plasmatique maximale d'AT-101 est observée 30 minutes après l'administration du médicament aux deux niveaux de dose, le groupe 200 mg/kg montrant une concentration plasmatique moyenne presque 4 fois supérieure à celle du groupe 35 mg/kg (7,88 μM et 27,78 μM respectivement) chez des souris SCID beige. L'AT-101 (25 mg/kg à 100 mg/kg, par voie orale) entraîne indéfiniment une apparition plus précoce d'une perte de poids équivalente à plus de 10 % du poids avant traitement et la mort chez les souris SCID beige. L'AT-101 (35 mg/kg, par voie orale par jour pendant 10 jours) plus le cyclophosphamide (Cy) intrapéritonéal et le rituximab (R) intrapéritonéal montrent un contrôle significatif du volume tumoral par rapport à tout autre groupe de traitement. L'AT-101 (15 mg/kg, p.o., 5 jours/semaine) en agent unique chez des souris intactes réduit significativement le développement de la croissance tumorale VCaP par rapport aux tumeurs non traitées aux semaines 2 à 6. L'AT-101 en combinaison avec la castration chirurgicale retarde l'apparition de la croissance tumorale VCaP indépendante des androgènes par rapport aux groupes castration seule ou AT-101 seule chez les souris.
|
Références |
|
Applications
| Méthodes | Biomarqueurs | Images | PMID |
|---|---|---|---|
| Growth inhibition assay | Cell viability |
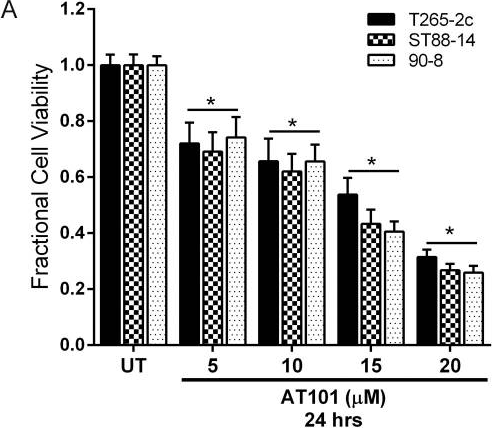
|
24824755 |
| Western blot | BNIP3 Smac / Cyt C p53 / Cox IV p-AKT / AKT APE1 / Bcl-2 / p53 / p-p53 / NF-κB |
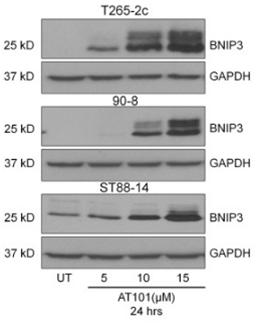
|
24824755 |
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT05338931 | Recruiting | B-cell Non Hodgkin Lymphoma |
AbClon |
March 15 2022 | Phase 1|Phase 2 |
| NCT00934076 | Withdrawn | Carcinoma Non Small Cell Lung |
University of Alabama at Birmingham|Ascenta Therapeutics |
February 2010 | Phase 1 |
| NCT00561197 | Terminated | Locally Advanced Esophageal or GE Junction Cancer |
Ascenta Therapeutics |
August 2007 | Phase 1|Phase 2 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
Foire aux questions
Question 1:
Is it S2812 (-)-gossypol or another enantiomer?
Réponse :
It is the R-(–)-gossypol acetic acid.
