pour la recherche uniquement
SU9516 CDK inhibiteur
Réf. CatalogueS7636
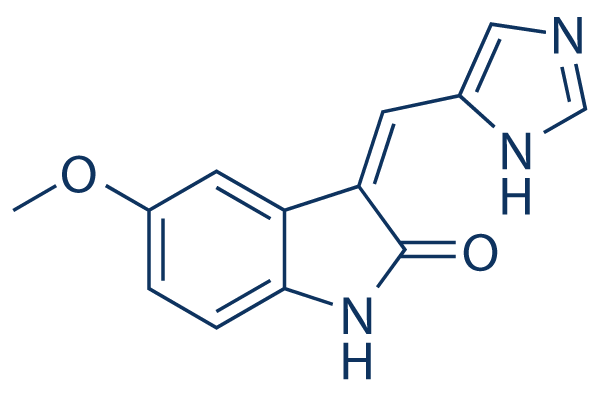
Structure chimique
Poids moléculaire: 241.25
Contrôle Qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- SDS
- Fiche technique
Informations chimiques, stockage et stabilité
| Poids moléculaire | 241.25 | Formule | C13H11N3O2 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 377090-84-1 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | COC1=CC2=C(C=C1)NC(=O)C2=CC3=CN=CN3 | ||
Solubilité
|
In vitro |
DMSO
: 48 mg/mL
(198.96 mM)
Ethanol : 12 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
CDK2
22 nM
CDK1
40 nM
CDK4
200 nM
|
|---|---|
| In vitro |
SU9516 diminue la phosphorylation spécifique de cdk2 de la protéine pRB du rétinoblastome, augmente l'activation de la caspase-3 et modifie le Cell Cycle dans les cellules RKO et SW480. Ce composé inhibe également la prolifération cellulaire et induit l'apoptose cellulaire dans les deux lignées cellulaires. Il tue les cellules leucémiques par inhibition de la phosphorylation de l'extrémité C-terminale de l'ARN polymérase II, des dommages oxydatifs et de la régulation transcriptionnelle négative de Mcl-1. Dans les cellules Jurkat de leucémie à cellules T humaines, ce produit chimique améliore significativement la sensibilité au méthotrexate. De plus, il supprime également la localisation centrosomale d'Aurora-A et l'amplification du centrosome qui en résulte.
|
| Essai kinase |
Essai de kinase CDK
|
|
Les essais de kinase sont effectués dans des plaques de polypropylène à 96 puits. Chaque réaction contenait 2 μg d'histone H1 à une concentration finale de 10 μM [γ-33P]ATP (0,2 μCi/puits ; environ deux fois le Km déterminé expérimentalement), 10 mM MgCl2, 1 mM DTT, 0,01 % de Triton X-100 et 10 % de glycérol dans un volume de 40 μL. La réaction est initiée par l'ajout de 20 μL d'enzyme (6 ng cdk2/puits, résultant en une concentration finale de 1,6 nM), qui est préalablement diluée de 1:50 à 1:200 dans le même tampon, et laissée se dérouler pendant 1 h à température ambiante. La réaction est arrêtée par l'ajout de 0,01 mL d'acide phosphorique à 10 %, et 25 μL du mélange réactionnel sont transférés sur du papier filtre de phosphocellulose P30. Le tapis filtrant est lavé trois fois avec 1,0 % d'acide phosphorique, séché à l'air, puis compté pour la radioactivité dans un compteur à scintillation liquide. L'essai de kinase cdk4 pour la cycline D1-cdk4 est réalisé dans un format de microplaques à 96 puits en polypropylène mesurant l'incorporation de phosphate radioactif dans le GST-Rb. La cycline D1-cdk4 purifiée est incubée avec 1 μg de GST-Rb dans 20 mM HEPES (pH 7,5) en présence de 10 mM MgCl2, 1 mM DTT, 0,01 % de Triton X-100 et 10 % de glycérol. La concentration finale de cdk4 est de 10 ng/puits, soit 1,6 nM. La réaction de kinase est initiée par l'ajout d'ATP à une concentration finale de 10 μM ATP (deux fois le Km déterminé expérimentalement) et de [γ-33P]ATP (1,0 μCi par puits) dans un volume de 60 μL et laissée se dérouler à température ambiante pendant 1 h. La réaction est arrêtée par l'ajout de 0,01 ml d'acide phosphorique à 10 %, et 25 μL du mélange réactionnel sont transférés sur du papier filtre de phosphocellulose P30. Le tapis filtrant est traité comme pour les essais Cdk1/Cdk2.
|
Références |
|
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
