pour la recherche uniquement
Gemfibrozil PPAR activateur
Réf. CatalogueS1729
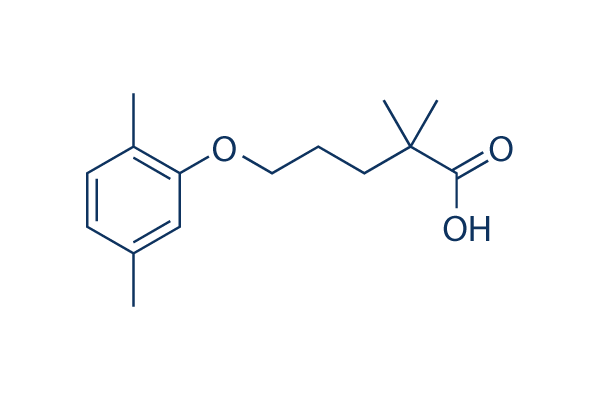
Structure chimique
Poids moléculaire: 250.33
Contrôle Qualité
| Cibles apparentées | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase Vitamin Carbohydrate Metabolism Mitochondrial Metabolism Drug Metabolite |
|---|---|
| Autre PPAR Inhibiteurs | T0070907 GW9662 GW6471 WY-14643 (Pirinixic Acid) GSK3787 GW0742 AZ6102 Harmine Astaxanthin Eupatilin |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 250.33 | Formule | C15H22O3 |
Stockage (À compter de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 25812-30-0 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | CI-719 | Smiles | CC1=CC(=C(C=C1)C)OCCCC(C)(C)C(=O)O | ||
Solubilité
|
In vitro |
DMSO
: 50 mg/mL
(199.73 mM)
Ethanol : 50 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Saisir les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Saisir la formulation in vivo (Ceci est seulement le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouterμL PEG300, mélanger et clarifier, puis ajouterμL Tween 80, mélanger et clarifier, puis ajouter μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, puis ajouter μL Huile de maïs, mélanger et clarifier.
Note : 1. Veuillez vous assurer que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue, lors de lajout précédent, est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie chaud peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
PPARα
|
|---|---|
| In vitro |
Gemfibrozil exerce un effet inhibiteur minimal sur l'oxydation de l'acide hydroxy simvastatine (SVA) médiée par le CYP3A, mais inhibe la glucuronidation du SVA dans les microsomes hépatiques de chien et d'humain. Ce composé inhibe de manière significative la formation de M-23, avec une valeur K(i) (IC(50)) de 69 (95) mM, tandis que l'inhibition de la formation de M-1 est plus faible avec une valeur K(i) (IC(50)) de 273 mM dans les microsomes hépatiques humains. Il inhibe fortement et de manière compétitive l'activité du CYP2C9, avec une valeur K(i) (IC(50)) de 5,8 (9,6) mM. Ce produit chimique présente des effets inhibiteurs légèrement plus faibles sur les activités du CYP2C19 et du CYP1A2, avec des valeurs K(i) (IC(50)) de 24 (47) mM et 82 (136) mM, respectivement. Ce composé, un médicament hypolipémiant, inhibe la production de NO induite par les cytokines et l'expression de la monoxyde d'azote synthase inductible (iNOS) dans les cellules astrogliales U373MG humaines et les astrocytes primaires. Il induit l'activité luciférase dépendante de l'élément de réponse aux proliférateurs de peroxysomes (PPRE), qui est inhibée par l'expression de DeltahPPAR-alpha, le mutant dominant-négatif du PPAR-alpha humain. Ce produit chimique inhibe fortement l'activation de NF-kappaB, AP-1 et C/EBPbeta mais pas celle du site d'activation gamma (GAS) dans les cellules astrogliales stimulées par les cytokines.
|
| In vivo |
Le traitement par Gemfibrozil réduit significativement (2-3 fois) la clairance plasmatique du SVA et l'excrétion biliaire du glucuronide de SVA (avec son produit de cyclisation SV), mais pas l'excrétion d'un métabolite oxydatif majeur du SVA chez les chiens.
|
Références |
|
Informations sur lessai clinique
(données du https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Promoteur/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT06064539 | Completed | Multiple Sclerosis |
Sanofi |
May 18 2020 | Phase 1 |
| NCT03832595 | Completed | Chronic Kidney Diseases |
University of Pittsburgh|Vanderbilt University Medical Center|National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) |
May 1 2019 | Not Applicable |
| NCT01736254 | Completed | Healthy Volunteers |
Eli Lilly and Company |
December 2012 | Phase 1 |
| NCT01797198 | Completed | Drug-Drug Interaction (DDI)|Healthy Subjects |
Astellas Pharma Europe B.V.|Astellas Pharma Inc |
April 2012 | Phase 1 |
| NCT01913379 | Completed | Healthy Subjects|Pharmacokinetics|Drug-Drug Interaction |
Astellas Pharma Europe B.V.|Medivation Inc.|Astellas Pharma Inc |
August 2011 | Phase 1 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
